Cumplimiento de las medidas de asepsia- se trata del uso de equipos y soluciones estériles y la prevención de su contaminación durante el trabajo. Las bacterias y las esporas de hongos están muy extendidas en el medio ambiente, incluso en los laboratorios. Los microbiólogos deben mantener la esterilidad de los medios y equipos de cultivo en todo momento. Estos “inconvenientes” son parte integral del trabajo de cualquier microbiólogo. Los laboratorios de las escuelas y universidades sólo enseñan precauciones básicas. El trabajo microbiológico de rutina requiere laboratorios especialmente equipados. Deben tener superficies fáciles de limpiar y áreas de trabajo (cajas) especialmente valladas que proporcionen un suministro de aire filtrado y estéril.
tazas para servir
tazas para servir Uno de los métodos microbiológicos más básicos. Una placa es una placa de Petri que contiene agar nutritivo. Las placas de Petri son recipientes redondos poco profundos especialmente fabricados que pueden ser de vidrio o plástico. Se utilizan para el crecimiento de bacterias, hongos o cultivos de tejidos en medios nutritivos sólidos. Normalmente las placas de Petri tienen unos 9 cm de diámetro. Los vasos de vidrio se pueden reutilizar después del tratamiento en autoclave. Los vasos de plástico se desechan después de su uso; normalmente se esterilizan en autoclave para destruir el cultivo. Al mismo tiempo se derriten. Los vasos se compran en paquetes sellados que se esterilizan mediante irradiación gamma. Las tapas evitan la contaminación del vaso, pero las moléculas de gas pueden difundirse entre el volumen interno del vaso y el medio ambiente a través de irregularidades microscópicas donde el fondo entra en contacto con la tapa. Por lo tanto, el oxígeno tiene acceso al cultivo y el dióxido de carbono se elimina al exterior.
Procedimiento de vertido En la figura se muestra el agar nutritivo derretido (“vertido en plato”). Se da a entender que el agar se preparó en pequeños viales (viales McCartney).
Métodos de inoculación
Para evitar la contaminación al introducir pequeñas cantidades de microorganismos en un medio de cultivo -inoculación (o siembra)- es necesario utilizar técnicas asépticas.
Los procedimientos de inoculación varían según el tipo de medio (líquido o sólido).
Siembra en medio sólido
Siembra por rayado o siembra por dilución.
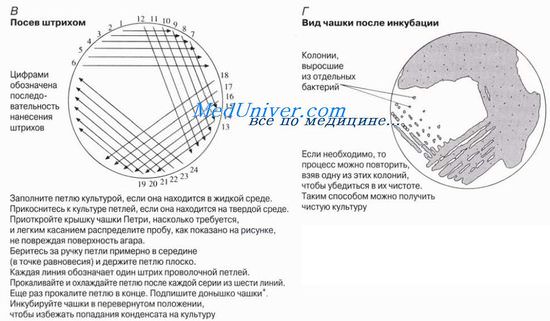
El método se presenta en la figura. Se utiliza para aislar colonias bacterianas puras de una mezcla de bacterias. Para la siembra se utiliza un lazo de alambre, el cual primero se debe calcinar, como se muestra en la Fig. 12,4, L, para esterilizar. Luego se retira una fina película de suspensión líquida o una pequeña cantidad de material sólido que contiene los microorganismos de interés utilizando un asa de un cultivo previamente cultivado u otra fuente de microorganismos. El bucle se pasa suavemente sobre la superficie del medio, realizando una serie de trazos. Después de cada serie de rayas, el plato se gira ligeramente para que cada nueva serie distribuya las bacterias de la serie de rayas anterior, agotando así las rayas en bacterias individuales. (¡No espere ver nada en los trazos finales antes de que termine el tiempo de incubación!) Una vez que se domina el método, los trazos se pueden realizar muy rápidamente.
Con este método, se pueden aislar bacterias de hábitats naturales, como el suelo, la leche y el agua. Es mejor suspender las muestras de sustancias sólidas, como el suelo, en una pequeña cantidad de agua o preincubarlas en un medio líquido. Una fuente segura para uso rutinario es la leche pasteurizada. Antes de experimentar con bacterias u hongos, conviene familiarizarse con las instrucciones y normas de seguridad para minimizar el riesgo de cultivar organismos nocivos.
Inoculación sobre superficie de agar
Este método se ilustra en la figura. Es conveniente para inocular microorganismos desde una suspensión líquida a un medio sólido. El método se utiliza para determinar la cantidad de células viables en una muestra después de diluciones en serie. También se puede utilizar para obtener un “césped” continuo de microorganismos en la superficie del agar después de una siembra densa. Esto es útil cuando se analiza la actividad de inhibidores, como antibióticos o desinfectantes, que se agregan a las depresiones hechas en el agar o se aplican a discos de papel de filtro colocados en la superficie del agar. El inhibidor se difunde a través del agar, formando una zona de inhibición del crecimiento alrededor de los orificios o discos del papel de filtro, que es visible después de la incubación. El diámetro de la zona puede servir como medida del grado de inhibición.
Sembrando vertiendo
Sembrando vertiendo Se utiliza un método alternativo al revestimiento de superficies con agar para inocular células de un cultivo líquido y también para contar células viables. Dado que las células están distribuidas por todo el medio, y no sólo en la superficie del agar, se pueden contar cantidades mucho mayores de ellas, hasta 1.000 colonias por placa. Sin embargo, el tamaño de las colonias cultivadas es mucho menor.
Volumen específico(hasta 0,5 cm 3) de la suspensión celular se añade a un volumen adecuado (aproximadamente 15-20 cm 3) de agar nutritivo esterilizado derretido en una botella pequeña, que previamente se ha enfriado a 45-50 ° C en un baño de agua. . Retire la tapa y queme el cuello del vial antes de agregar la suspensión celular, como se muestra en la figura. La suspensión celular se mezcla bien con agar nutritivo, girando (sin agitar) el frasco que se sostiene en las palmas de un lado a otro. Luego vierta la mezcla en una placa de Petri esterilizada como se muestra en la figura. Firma el fondo de la copa e incúbala. Después de la incubación, la placa tiene el aspecto que se muestra en la figura.
Siembra por inyección
Método Se utiliza para el cultivo de organismos anaeróbicos u organismos que crecen con bajas concentraciones de oxígeno (microaerófilos). Normalmente se utiliza un tubo que contiene medio de agar nutritivo. Debido a la pequeña superficie y la profundidad bastante grande del agar en el tubo de ensayo en comparación con la copa, el acceso de oxígeno al interior del agar es limitado. La siembra se realiza con alambre recto (sin bucle) o con aguja bacteriológica. Se toma una pequeña cantidad de cultivo (sólido o líquido) con la punta de una aguja y luego se perfora verticalmente en el agar. El cultivo crece en agar en todas direcciones desde la línea de punción.
