Za ponudbo: Leonova M.V. Nova in obetavna zdravila, ki blokirajo sistem renin-angiotenzin-aldosteron // Rak dojke. Zdravniški pregled. 2013. št. 17. Str. 886
Vloga renin-angiotenzin-aldosteronskega sistema (RAAS) pri razvoju arterijske hipertenzije (AH) in drugih srčno-žilnih bolezni trenutno velja za prevladujočo. V kardiovaskularnem kontinuumu je hipertenzija med dejavniki tveganja, glavni patofiziološki mehanizem poškodbe srčno-žilnega sistema pa je angiotenzin II (ATII). ATII je ključna komponenta RAAS – efektor, ki izvaja vazokonstrikcijo, zadrževanje natrija, aktivacijo simpatičnega živčnega sistema, celično proliferacijo in hipertrofijo, razvoj oksidativnega stresa in vnetja žilne stene.
Trenutno sta že razvita in klinično široko uporabljena dva razreda zdravil, ki blokirajo RAAS - zaviralci ACE in zaviralci receptorjev ATII. Farmakološki in klinični učinki teh razredov se razlikujejo. ACE je peptidaza iz skupine cinkovih metaloproteinaz, ki presnavlja ATI, AT1-7, bradikinin, substanco P in številne druge peptide. Mehanizem delovanja zaviralcev ACE je povezan predvsem s preprečevanjem nastajanja ATII, kar spodbuja vazodilatacijo, natriurezo in odpravlja proinflamatorne, proliferativne in druge učinke ATII. Poleg tega zaviralci ACE preprečujejo razgradnjo bradikinina in zvišujejo njegovo raven. Bradikinin je močan vazodilatator, potencira natriurezo, predvsem pa deluje kardioprotektivno (preprečuje hipertrofijo, zmanjšuje ishemično poškodbo miokarda, izboljša koronarno prekrvavitev) in vazoprotektivno, izboljšuje delovanje endotelija. Hkrati je visoka raven bradikinina vzrok za razvoj angioedema, kar je ena od resnih pomanjkljivosti zaviralcev ACE, ki bistveno povečajo raven kininov.
Zaviralci ACE ne morejo vedno popolnoma blokirati tvorbe ATII v tkivih. Zdaj je ugotovljeno, da lahko pri njegovi transformaciji v tkivih sodelujejo tudi drugi encimi, ki niso povezani z ACE, predvsem endopeptidaze, na katere zaviralci ACE ne vplivajo. Zaradi tega zaviralci ACE ne morejo popolnoma odpraviti učinkov ATII, kar je lahko razlog za njihovo neučinkovitost.
Rešitev tega problema je olajšala odkritje receptorjev ATII in prvega razreda zdravil, ki selektivno blokirajo receptorje AT1. Preko AT1 receptorjev se realizirajo neželeni učinki ATII: vazokonstrikcija, izločanje aldosterona, vazopresina, noradrenalina, zastajanje tekočine, proliferacija gladkih mišičnih celic in kardiomiocitov, aktivacija SAS, kot tudi mehanizem negativne povratne zveze - tvorba renina. . Receptorji AT2 opravljajo "uporabne" funkcije, kot so vazodilatacija, procesi popravljanja in regeneracije, antiproliferativni učinki, diferenciacija in razvoj embrionalnih tkiv. Klinični učinki zaviralcev receptorjev ATII so posredovani z odpravo "škodljivih" učinkov ATII na ravni receptorjev AT1, kar zagotavlja popolnejšo blokado neželenih učinkov ATII in povečanje vpliva ATII na receptorje AT2. , ki dopolnjuje vazodilatacijske in antiproliferativne učinke. Zaviralci receptorjev ATII imajo specifičen učinek na RAAS, ne da bi motili kininski sistem. Pomanjkanje vpliva na aktivnost kininskega sistema po eni strani zmanjša resnost neželenih učinkov (kašelj, angioedem), po drugi strani pa blokatorjem receptorjev ATII odvzame pomemben antiishemični in vazoprotektivni učinek, kar jih razlikuje od zaviralcev ACE. Zato indikacije za uporabo blokatorjev receptorjev ATII večinoma ponavljajo indikacije za uporabo zaviralcev ACE in so le-ti alternativna zdravila.
Kljub uvedbi zaviralcev RAAS v široko prakso pri zdravljenju hipertenzije ostajajo težave z izboljšanjem izidov in prognoze. Med njimi so: možnost izboljšanja nadzora krvnega tlaka v populaciji, učinkovitost zdravljenja rezistentne hipertenzije ter možnost nadaljnjega zmanjševanja tveganja za srčno-žilne bolezni.
Iskanje novih načinov vplivanja na RAAS se aktivno nadaljuje; Preučujejo se drugi tesno medsebojno povezani sistemi in ustvarjajo se zdravila z več mehanizmi delovanja, kot so zaviralci ACE in nevtralne endopeptidaze (NEP), endotelin-konvertazni encim (ACE) in zaviralci NEP, zaviralci ACE/NEP/EGT.
Zaviralci vazopeptidaze
Vazopeptidaze poleg znane ACE vključujejo še dve drugi cinkovi metaloproteinazi - neprilizin (nevtralna endopeptidaza, NEP) in endotelin-konvertazni encim, ki sta prav tako lahko tarči farmakološkega delovanja.
Neprilysin je encim, ki ga proizvaja vaskularni endotelij in sodeluje pri razgradnji natriuretičnega peptida ter bradikinina.
Sistem natriuretičnih peptidov predstavljajo tri različne izooblike: atrijski natriuretični peptid (A-tip), možganski natriuretični peptid (B-tip), ki se sintetizirajo v atriju in miokardu, in endotelijski C-peptid, ki so po svoji biološki funkciji endogenih zaviralcev RAAS in endotelina-1 (tabela 1). Kardiovaskularni in ledvični učinki natriuretičnega peptida vključujejo znižanje krvnega tlaka z njegovim učinkom na žilni tonus in vodno-elektrolitno ravnovesje ter antiproliferativne in antifibrotične učinke na ciljne organe. Najnovejši dokazi kažejo, da je sistem natriuretičnih peptidov vključen v presnovno regulacijo: oksidacijo lipidov, tvorbo in diferenciacijo adipocitov, aktivacijo adiponektina, izločanje insulina in toleranco za ogljikove hidrate, kar lahko zagotovi zaščito pred razvojem presnovnega sindroma.
Zdaj je postalo znano, da je razvoj bolezni srca in ožilja povezan z disregulacijo sistema natriuretičnih peptidov. Tako pri hipertenziji pride do pomanjkanja natriuretičnega peptida, kar vodi do občutljivosti na sol in oslabljene natriureze; pri kroničnem srčnem popuščanju (CHF) v ozadju pomanjkanja opazimo nenormalno delovanje hormonov natriuretičnega peptidnega sistema.
Zato je za potenciranje natriuretičnega peptidnega sistema, da bi dosegli dodatne hipotenzivne in zaščitne kardiorenalne učinke, mogoče uporabiti zaviralce NEP. Zaviranje neprilizina vodi do povečanja natriuretičnega, diuretičnega in vazodilatacijskega učinka endogenega natriuretičnega peptida in posledično do znižanja krvnega tlaka. Vendar pa je NEP vključen tudi v razgradnjo drugih vazoaktivnih peptidov, zlasti ATI, ATII in endotelina-1. Zato je ravnotežje učinkov zaviralcev NEP na žilni tonus spremenljivo in odvisno od prevlade konstriktorskih in dilatacijskih učinkov. Pri dolgotrajni uporabi je antihipertenzivni učinek zaviralcev neprilizina šibek zaradi kompenzacijske aktivacije tvorbe ATII in endotelina-1.
V zvezi s tem lahko kombinacija učinkov zaviralcev ACE in zaviralcev NEP pomembno potencira hemodinamske in antiproliferativne učinke zaradi komplementarnega mehanizma delovanja, kar je privedlo do nastanka zdravil z dvojnim mehanizmom delovanja, s skupnim imenom vazopeptidaza. inhibitorji (tabela 2, slika 1).
Za znane zaviralce vazopeptidaze so značilne različne stopnje selektivnosti za NEP/ACE: omapatrilat - 8,9:0,5; fasidoprilat - 5,1:9,8; Sampatrilat - 8,0:1,2. S tem so zaviralci vazopeptidaze pridobili veliko večji potencial za doseganje hipotenzivnega učinka ne glede na aktivnost RAAS in stopnjo retencije natrija ter pri zaščiti organov (regresija hipertrofije, albuminurije, žilne togosti). V kliničnih študijah je bil najbolj raziskan omapatrilat, ki je pokazal večjo antihipertenzivno učinkovitost v primerjavi z zaviralci ACE, pri bolnikih s CHF pa je povzročil povečanje iztisnega deleža in izboljšanje kliničnih izidov (študije IMPRESS, OVERTURE), vendar brez prednosti pred zaviralci ACE.
Vendar so v velikih kliničnih preskušanjih z uporabo omapatrilata ugotovili večjo incidenco angioedema v primerjavi z zaviralci ACE. Znano je, da je incidenca angioedema pri uporabi zaviralcev ACE v populaciji od 0,1 do 0,5%, od tega je 20% primerov življenjsko nevarnih, kar je povezano z večkratnim povečanjem koncentracije bradikinina in njegovih presnovkov. Rezultati velike multicentrične študije OCTAVE (n = 25.302), ki je bila posebej zasnovana za preučevanje incidence angioedema, so pokazali, da je incidenca tega neželenega učinka med zdravljenjem z omapatrilatom večja kot v skupini z enalaprilom - 2,17% v primerjavi z 0,68% ( relativno tveganje 3.4) . To so razložili s povečanim učinkom na ravni kininov s sinergistično inhibicijo ACE in NEP, povezano z inhibicijo aminopeptidaze P, ki sodeluje pri razgradnji bradikinina.
Nov dvojni zaviralec vazopeptidaze, ki blokira ACE/NEP, je ilepatril, ki ima večjo afiniteto za ACE v primerjavi z NEP. Pri proučevanju farmakodinamičnih učinkov ilepatrila na aktivnost RAAS in natriuretičnega peptida pri zdravih prostovoljcih je bilo ugotovljeno, da zdravilo odvisno od odmerka (v odmerkih 5 in 25 mg) in pomembno (več kot 88 %) zavira ACE v krvne plazme v trajanju več kot 48 ur, ne glede na občutljivost na sol. Hkrati je zdravilo znatno povečalo aktivnost renina v plazmi v 48 urah in znižalo raven aldosterona. Ti rezultati so pokazali izrazito in dolgotrajnejšo supresijo RAAS v nasprotju z zaviralcem ACE ramiprilom v odmerku 10 mg, kar so pojasnili z izrazitejšim tkivnim učinkom ilepatrila na ACE in večjo afiniteto za ACE ter primerljivo stopnjo blokade RAAS v primerjavi s kombinacijo 150 mg irbesartana + 10 mg ramiprila. V nasprotju z učinkom na RAAS se je učinek ilepatrila na natriuretični peptid pokazal s kratkotrajnim povečanjem stopnje njegovega izločanja v obdobju 4-8 ur po zaužitju odmerka 25 mg, kar kaže na nižjo in šibkejšo afiniteto za NEP in ga razlikuje od omapatrilata. Poleg tega glede stopnje izločanja elektrolitov zdravilo nima dodatnega natriuretičnega učinka v primerjavi z ramiprilom ali irbesartanom, kot ga imajo drugi zaviralci vazopeptidaze. Največji hipotenzivni učinek se razvije 6-12 ur po zaužitju zdravila, znižanje povprečnega krvnega tlaka pa je 5±5 in 10±4 mmHg. pri nizki oziroma visoki občutljivosti na sol. Po farmakokinetičnih značilnostih je ilepatril predzdravilo z aktivnim presnovkom, ki se hitro tvori, doseže največjo koncentracijo po 1-1,5 ure in se počasi izloča. Trenutno potekajo klinična preskušanja faze III.
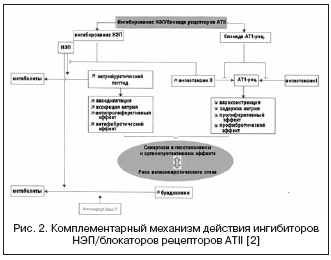
Alternativno pot do dvojne supresije RAAS in NEP predstavlja kombinacija ATII in blokade receptorjev NEP (slika 2). Zaviralci receptorjev ATII ne vplivajo na presnovo kininov, za razliko od zaviralcev ACE, zato imajo potencialno manjše tveganje za razvoj zapletov angioedema. Trenutno je prvo zdravilo, zaviralec receptorjev ATII z učinkom zaviranja NEP v razmerju 1:1, LCZ696, v kliničnih preskušanjih faze III. Kombinirana molekula zdravila vsebuje valsartan in inhibitor NEP (AHU377) v obliki predzdravila. V veliki študiji pri bolnikih s hipertenzijo (n=1328) je LCZ696 v odmerkih 200-400 mg pokazal prednost v hipotenzivnem učinku pred valsartanom v odmerkih 160-320 mg v obliki dodatnega znižanja krvnega tlaka za 5 /3 in 6/3 mmHg. . Hipotenzivni učinek LCZ696 je spremljalo izrazitejše znižanje pulznega krvnega tlaka: za 2,25 in 3,32 mmHg. v odmerkih 200 oziroma 400 mg, kar trenutno velja za pozitiven prognostični dejavnik za učinek na togost žilne stene in srčno-žilne izide. Istočasno je študija nevrohumoralnih biomarkerjev med zdravljenjem z LCZ696 pokazala povečanje ravni natriuretičnega peptida s primerljivo stopnjo povečanja ravni renina in aldosterona v primerjavi z valsartanom. Prenašanje pri bolnikih s hipertenzijo je bilo dobro in niso opazili nobenega primera angioedema. Študija PARAMOUMT je bila zdaj zaključena pri 685 bolnikih s kongestivnim srčnim popuščanjem in neoporečno EF. Rezultati študije so pokazali, da LCZ696 hitreje in pomembneje zmanjša raven NT-proBNP (primarni opazovani dogodek je marker povečane aktivnosti natriuretičnega peptida in slabe prognoze pri CHF) v primerjavi z valsartanom ter zmanjša tudi velikost levega atrija, kar kaže na regresijo njegove remodelacije . Študija pri bolnikih s kongestivnim srčnim popuščanjem in zmanjšano EF trenutno poteka (študija PARADIGM-HF).
Zaviralci endotelinskega sistema
Endotelinski sistem ima pomembno vlogo pri uravnavanju žilnega tonusa in regionalnega pretoka krvi. Med tremi znanimi izooblikami je endotelin-1 najbolj aktiven. Poleg znanih vazokonstriktorskih učinkov endotelin spodbuja proliferacijo in sintezo medceličnega matriksa, poleg tega pa zaradi neposrednega vpliva na tonus ledvičnih žil sodeluje pri uravnavanju homeostaze vode in elektrolitov. Učinki endotelina se uresničujejo z interakcijo s specifičnimi receptorji tipa A in B, katerih funkcije so medsebojno nasprotne: vazokonstrikcija poteka preko receptorjev tipa A, vazodilatacija pa preko receptorjev tipa B. V zadnjih letih je bilo ugotovljeno, da imajo receptorji tipa B pomembno vlogo pri očistku endotelina-1, tj. ko so ti receptorji blokirani, je od receptorja odvisen očistek endotelina-1 moten in njegova koncentracija se poveča. Poleg tega so receptorji tipa B vključeni v uravnavanje ledvičnih učinkov endotelina-1 in vzdrževanje homeostaze tekočine in elektrolitov, kar je pomembno.
Trenutno je dokazana vloga endotelina pri razvoju številnih bolezni, vklj. hipertenzija, CHF, pljučna hipertenzija, kronična ledvična bolezen; dokazana je tesna povezava med ravnmi endotelina in presnovnim sindromom, endotelijsko disfunkcijo in aterogenezo. Od leta 1990 poteka iskanje antagonistov endotelinskih receptorjev, primernih za klinično uporabo; Znanih je že 10 zdravil (»sentanov«) z različnimi stopnjami selektivnosti za receptorje tipa A/B. Prvi neselektivni antagonist endotelinskih receptorjev, bosentan, je v klinični študiji pri bolnikih s hipertenzijo pokazal antihipertenzivno učinkovitost, primerljivo z učinkovitostjo zaviralca ACE enalaprila. Nadaljnje študije učinkovitosti uporabe antagonistov endotelina pri hipertenziji so pokazale njihov klinični pomen pri zdravljenju rezistentne hipertenzije in visokega srčno-žilnega tveganja. Ti podatki so bili pridobljeni iz dveh velikih kliničnih preskušanj, DORADO (n=379) in DORADO-AC (n=849), v katerih je bil darusentan dodan trojni kombinirani terapiji pri bolnikih z rezistentno hipertenzijo. V študiji DORADO so pri bolnikih z rezistentno hipertenzijo v kombinaciji s kronično ledvično boleznijo in proteinurijo zaradi dodajanja darusentana opazili ne le pomembno znižanje krvnega tlaka, temveč tudi zmanjšanje izločanja beljakovin. Antiproteinurični učinek antagonistov endotelinskih receptorjev je bil nato potrjen v študiji pri bolnikih z diabetično nefropatijo, ki so uporabljali avosentan. V študiji DORADO-AS pa niso ugotovili prednosti pri dodatnem znižanju krvnega tlaka pred primerjalnimi zdravili in placebom, kar je bil razlog za prekinitev nadaljnjih študij. Poleg tega so 4 velike študije antagonistov endotelina (bosentan, darusentan, enrasentan) pri bolnikih s kongestivnim srčnim popuščanjem pokazale nasprotujoče si rezultate, kar je bilo razloženo s povečanjem koncentracij endotelina-1. Nadaljnja študija antagonistov endotelinskih receptorjev je bila prekinjena zaradi neželenih učinkov, povezanih z zastajanjem tekočine (periferni edem, volumska preobremenitev). Razvoj teh učinkov je povezan z delovanjem antagonistov endotelina na receptorje tipa B, kar je spremenilo iskanje zdravil, ki vplivajo na endotelinski sistem po drugih poteh; in antagonisti endotelinskih receptorjev imajo trenutno samo eno indikacijo - zdravljenje pljučne hipertenzije.
Glede na velik pomen endotelinskega sistema pri regulaciji žilnega tonusa poteka iskanje drugega mehanizma delovanja preko vazopeptidaze - EPF, ki sodeluje pri tvorbi aktivnega endotelina-1 (slika 3). Blokiranje ACE in njegova kombinacija z inhibicijo NEP lahko učinkovito zavre tvorbo endotelina-1 in potencira učinke natriuretičnega peptida. Prednosti dvojnega mehanizma delovanja so na eni strani preprečevanje pomanjkljivosti zaviralcev NEP, povezanih z možno vazokonstrikcijo, ki jo povzroča aktivacija endotelina, po drugi strani pa natriuretična aktivnost zaviralcev NEP omogoča kompenzacijo zastajanja tekočine, povezanega z neselektivna blokada endotelinskih receptorjev. Daglutril je dvojni zaviralec NEP in ACE, ki je v fazi II kliničnih preskušanj. Študije so pokazale izrazite kardioprotektivne učinke zdravila zaradi zmanjšanja preoblikovanja srca in ožilja, regresije hipertrofije in fibroze.
Neposredni zaviralci renina
Znano je, da zaviralci ACE in zaviralci receptorjev ATII povečajo aktivnost renina preko povratnega mehanizma, zato je učinkovitost zaviralcev RAAS izmika. Renin predstavlja prvi korak kaskade RAAS; proizvajajo ga jukstaglomerularne celice ledvic. Renin prek angiotenzinogena pospešuje nastanek ATII, vazokonstrikcijo in izločanje aldosterona, uravnava pa tudi povratne mehanizme. Zato nam inhibicija renina omogoča, da dosežemo popolnejšo blokado sistema RAAS. Iskanje zaviralcev renina poteka že od sedemdesetih let prejšnjega stoletja; Dolgo časa ni bilo mogoče dobiti peroralne oblike zaviralcev renina zaradi njihove nizke biološke uporabnosti v prebavilih (manj kot 2 %). Prvi neposredni zaviralec renina, primeren za peroralno uporabo, aliskiren, je bil registriran leta 2007. Aliskiren ima nizko biološko uporabnost (2,6 %), dolgo razpolovno dobo (24-40 ur) in ekstrarenalno pot izločanja. Farmakodinamika aliskirena je povezana z 80-odstotnim znižanjem ravni ATII. V kliničnih študijah pri bolnikih s hipertenzijo je aliskiren v odmerkih 150-300 mg/dan povzročil znižanje SBP za 8,7-13 in 14,1-15,8 mmHg. in DBP - za 7,8-10,3 in 10,3-12,3 mm Hg. . Hipotenzivni učinek aliskirena so opazili pri različnih podskupinah bolnikov, vključno z bolniki s presnovnim sindromom, debelostjo; po resnosti je bil primerljiv z učinkom zaviralcev ACE, blokatorjev receptorjev ATII, aditivni učinek pa so opazili tudi v kombinaciji z valsartanom, hidroklorotiazidom in amlodipinom. Številne klinične študije so pokazale organoprotektivne učinke zdravila: antiproteinuričen učinek pri bolnikih z diabetično nefropatijo (študija AVOID, n=599), regresijo hipertrofije levega prekata pri bolnikih s hipertenzijo (študija ALLAY, n=465). Tako so v študiji AVOID po 3 mesecih zdravljenja z losartanom v odmerku 100 mg/dan in doseganju ciljne ravni krvnega tlaka (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Poleg tega se izvaja vrsta kliničnih študij aliskirena pri zdravljenju drugih srčno-žilnih bolezni za oceno učinka na prognozo bolnikov: ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n=7000). ) študije pri bolnikih s kongestivnim srčnim popuščanjem, študija ALTITUDE pri bolnikih s sladkorno boleznijo in visokim srčno-žilnim tveganjem, študija ASPIRE pri bolnikih s preoblikovanjem po infarktu.
Zaključek
Za reševanje problemov preprečevanja bolezni srca in ožilja se nadaljuje ustvarjanje novih zdravil s kompleksnim večkratnim mehanizmom delovanja, ki omogoča popolnejšo blokado RAAS s kaskado mehanizmov hemodinamske in nevrohumoralne regulacije. Potencialni učinki takšnih zdravil omogočajo ne le zagotavljanje dodatnega hipotenzivnega učinka, temveč tudi doseganje nadzora krvnega tlaka pri bolnikih z visokim tveganjem, vključno z rezistentno hipertenzijo. Zdravila z več mehanizmi delovanja kažejo prednosti v izrazitejšem organoprotektivnem učinku, ki bo preprečil nadaljnje poškodbe srčno-žilnega sistema. Preučevanje koristi novih zdravil, ki blokirajo RAAS, zahteva nadaljnje raziskave in oceno njihovega vpliva na prognozo bolnikov s hipertenzijo in drugimi srčno-žilnimi boleznimi.



Literatura
1. Campbell D.J. Inhibicija vazopeptidaze: dvorezen meč? // Hipertenzija. 2003. Vol. 41. Str. 383-389.
2. Laurent S., Schlaich M., Esler M. Nova zdravila, postopki in naprave za hipertenzijo // Lancet. 2012. letnik 380. P. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Zaviralci vazopeptidaze: nov terapevtski koncept pri boleznih srca in ožilja? // Naklada. 2001. Vol. 104. Str. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Inhibicija nevtralne endopeptidaze in natriuretični peptidni sistem: razvijajoča se strategija v terapevtiki srca in ožilja // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Primerjava zaviralca vazopeptidaze, omapatrilata in lizinoprila na toleranco za vadbo in obolevnost pri bolnikih s srčnim popuščanjem: randomizirano preskušanje IMPRESS // Lancet. 2000. Vol. 356. P. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. Primerjava omapatrilata in enalaprila pri bolnikih s kroničnim srčnim popuščanjem: Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002. Vol. 106. P. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Zaviralci receptorjev angiotenzina II pri bolnikih z angioedemom, povzročenim z zaviralci ACE // Ann. Pharmacother. 2000. Vol. 34. Str. 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat in enalapril pri bolnikih s hipertenzijo: preskušanje Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) // Am. J. Hipertenzija. 2004. Vol. 17. Str. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Farmakokinetika in farmakodinamika zaviralca vazopeptidaze AVE7688 pri ljudeh // Clin. Pharmacol. Ther. 2006. Vol. 79. Str. 49-61.
10. Gu J., Noe A., Chandra P. et al. Farmakokinetika in farmakodinamika LCZ696, novega zaviralca neprilizina z dvojnim delovanjem angiotenzinskega receptorja (ARNi) // J. Clin. Pharmacol. 2010. Vol. 50. Str. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Znižanje krvnega tlaka z LCZ696, novim dvojno delujočim zaviralcem receptorja angiotenzina II in neprilizina: randomizirana, dvojno slepa, s placebom nadzorovana študija aktivnega primerjalnega zdravila // Lancet. 2010. Vol. 375. P. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. Zaviralec neprilizina angiotenzinskega receptorja LCZ696 pri srčnem popuščanju z ohranjenim iztisnim deležem: dvojno slepo randomizirano kontrolirano preskušanje 2. faze // Lancet. 2012. letnik 380 (9851). P. 1387-1395.
13. Levin E.R. Endotelini // N. Engl. J. Med. 1995. Vol. 333. P. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Vloga endotelina-1 pri klinični hipertenziji: 20 let pozneje // Hipertenzija. 2008. Vol. 52. Str. 452-459.
15. Burnier M., Forni V. Antagonisti endotelinskih receptorjev: mesto pri zdravljenju esencialne hipertenzije? //Nephrol. Dial. Presaditev. 2011. 0: 1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R. J., Lacourciere Y. et al. Učinek antagonista endotelinskega receptorja, bosentana, na krvni tlak pri bolnikih z esencialno hipertenzijo. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998. Vol. 338. P. 784-790.
17. Weber M.A., Black H., Bakris G. et al. Selektivni antagonist endotelinskih receptorjev za znižanje krvnega tlaka pri bolnikih s hipertenzijo, odporno na zdravljenje: randomizirano, dvojno slepo, s placebom kontrolirano preskušanje // Lancet. 2009. Vol. 374. P. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Različni rezultati z uporabo kliničnega in ambulantnega krvnega tlaka: poročilo o preskušanju hipertenzije, odporne na darusentan // Hipertenzija. 2010. Vol. 56. Str. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan za očitno diabetično nefropatijo // J. Am. Soc. Nefrol. 2010. Vol. 21. Str. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Encim za pretvorbo endotelina/nevtralni zaviralec endopeptidaze SLV338 preprečuje hipertenzivno preoblikovanje srca na način, neodvisen od krvnega tlaka // Hipertenzija. 2011. letnik 57. P. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Zaviranje angiotenzina II pri ljudeh s teoretično aktivnim zaviralcem renina aliskirenom (SPP100): primerjava z enalaprilom // Hipertenzija. 2002. Vol. 39(1). Str. E1-8.
22. Alreja G., Joseph J. Renin in srčno-žilne bolezni: izrabljena pot ali nova smer? // World J. Cardiol. 2011. letnik 3(3). Str. 72-83.
23. Ingelfinger J.R. Aliskiren in dvojna terapija pri sladkorni bolezni tipa 2 // N. Engl. J. Med. 2008. Vol. 358(23). P. 2503-2505.
24. Pouleur A.S., Uno H., Prescott M.F., Desai A. (za raziskovalce ALLAY). Supresija aldosterona posreduje regresijo hipertrofije levega prekata pri bolnikih s hipertenzijo // J. Renin-angiotenzin-aldosteronski sistem. 2011. letnik 12. Str. 483-490.
25. Kelly D. J., Zhang Y., Moe G. et al. Aliskiren, nov zaviralec renina, deluje renoprotektivno v modelu napredovale diabetične nefropatije pri podganah // Diabetol. 2007. Vol. 50. P. 2398-2404.
Zgodovina preučevanja renin-angiotenzinaldosteronskega sistema (RAAS), ki se je izkazala za najuspešnejšo v smislu razvoja pristopov k farmakološki modulaciji njegove aktivnosti, kar omogoča podaljšanje življenja bolnikov s srčno-žilnimi in ledvičnimi boleznimi, se je začela pred 110 leti. . Ko je bil identificiran renin, prva komponenta. Kasneje je bilo v eksperimentalnih in kliničnih študijah mogoče razjasniti fiziološko vlogo renina in njegov pomen pri uravnavanju aktivnosti RAAS v različnih patoloških stanjih, kar je postalo osnova za razvoj zelo učinkovite terapevtske strategije - neposrednih zaviralcev renina.
Trenutno je prvi neposredni zaviralec renina Rasilez (aliskiren) upravičen tudi v primerih, ko drugi zaviralci RAAS - zaviralci ACE in ARB niso indicirani ali pa je njihova uporaba otežena zaradi razvoja neželenih učinkov.
Druga okoliščina, ki nam omogoča, da računamo na dodatne zmožnosti neposrednih zaviralcev renina pri zaščiti ciljnih organov hipertenzije v primerjavi z drugimi zaviralci RAAS, je, da se pri uporabi zdravil, ki blokirajo RAAS na drugih ravneh, po zakonu negativne povratne zveze poveča koncentracije prorenina in povečanja aktivnosti renina v plazmi. Prav ta okoliščina izniči pogosto opaženo zmanjšanje učinkovitosti zaviralcev ACE, tudi z vidika njihove sposobnosti zniževanja visokega krvnega tlaka. Že v zgodnjih devetdesetih letih prejšnjega stoletja, ko številni organoprotektivni učinki zaviralcev ACE niso bili tako zanesljivo ugotovljeni kot danes, se je izkazalo, da se z večanjem njihovega odmerka pomembno poveča aktivnost renina v plazmi in koncentracija angiotenzina v plazmi. Poleg zaviralcev ACE in ARB lahko tudi tiazidni diuretiki in diuretiki Henlejeve zanke povzročijo povečanje aktivnosti renina v plazmi.
Prvi neposredni zaviralec renina, katerega učinkovitost je bila potrjena v kontroliranih kliničnih preskušanjih III. zdravljenje hipertenzije. Primerjali smo njegov vpliv na plazemsko koncentracijo in aktivnost posameznih sestavin RAAS z zaviralci ACE in ARB. Izkazalo se je, da aliskiren in enalapril skoraj enako zmanjšata plazemsko koncentracijo angiotenzina II, vendar je za razliko od aliskirena jemanje enalaprila povzročilo več kot 15-kratno povečanje aktivnosti renina v krvni plazmi. Sposobnost aliskirena, da prepreči negativne spremembe v ravnovesju aktivnosti komponent RAAS, je bila dokazana tudi v primerjavi z ARB.
Združena analiza kliničnih študij, ki so vključevale skupaj 8481 bolnikov, ki so prejemali aliskiren v monoterapiji ali placebo, je pokazala, da je enkratni odmerek aliskirena v odmerku 150 mg/dan. ali 300 mg/dan. povzročil znižanje SBP za 12,5 in 15,2 mmHg. v primerjavi z zmanjšanjem za 5,9 mmHg pri placebu (P<0,0001). Диастолическое АД снижалось на 10,1 и 11,8 мм рт.ст. соответственно (в группе, принимавшей плацебо – на 6,2 мм рт.ст.; Р < 0,0001). Различий в антигипертензивном эффекте алискирена у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено.
Leta 2009 so bili objavljeni rezultati multicentrične kontrolirane klinične raziskave, v kateri so primerjali učinkovitost aliskirena in hidroklorotiazida pri 1124 bolnikih s hipertenzijo. Po potrebi smo tem zdravilom dodali amlodipin. Že ob koncu obdobja monoterapije je postalo jasno, da aliskiren vodi do izrazitejšega znižanja krvnega tlaka kot hidroklorotiazid (-17,4/-12,2 mmHg v primerjavi z -14,7/-10,3 mmHg; R< 0,001)
Neposredni zaviralec renina (aliskiren)
Izločanje renina v ledvicah je stimulirano z zmanjšanjem volumna cirkulirajoče krvi in perfuzije ledvic. Renin pa pretvori angiotenzinogen v angiotenzin I, prekurzor angiotenzina II, slednji pa sproži kaskado reakcij, ki vodijo do zvišanja krvnega tlaka. Tako lahko supresija izločanja renina zmanjša nastajanje angiotenzina II. Pri jemanju tiazidnih diuretikov, zaviralcev ACE in ARB se aktivnost renina v plazmi poveča. Zato je lahko zaviranje aktivnosti renina potencialno učinkovita strategija za zatiranje celotnega sistema renin-angiotenzin. Aliskiren je prvo iz nove skupine zdravil - neposredni zaviralec renina, ki ima dokazano antihipertenzivno delovanje. Izboljšana biološka uporabnost peroralnega aliskirena v primerjavi s predhodno ponujenimi zdravili te vrste in dolga razpolovna doba omogočata jemanje tega zdravila enkrat na dan.
Aliskiren učinkovito znižuje krvni tlak tako v monoterapiji kot v kombinaciji s tiazidnimi diuretiki (hidroklorotiazid), zaviralci ACE (ramipril, lizinopril). ARB (valsartan) ali CCB (amlodipin). Ko se aliskiren jemlje s temi antihipertenzivi, se aktivnost renina v plazmi ne poveča, ampak ostane na bazalni ravni ali celo pod njo. Varnost in prenašanje zdravila Alixiren je podobno placebu in ne deluje s širokim spektrom zdravil, razen s furosemidom. Trenutno je malo podatkov o dolgoročni učinkovitosti in prenašanju aliskirena pri sladkornih bolnikih s hipertenzijo. Posledično natančna vloga tega zdravila pri zdravljenju hipertenzije pri bolnikih s sladkorno boleznijo ni bila v celoti ugotovljena.
ALISKIREN (zdravilo Rasilez) – tablete 150 mg in 300 mg, začetni odmerek 150 mg/1-krat na dan, če nadzor krvnega tlaka ni zadosten, lahko po 2 tednih odmerek povečate na 300 mg/1-krat na dan.
Mehanizem delovanja. Antihipertenziv, selektivni zaviralec renina nepeptidne strukture. Če se aliskiren uporablja kot monoterapija in v kombinaciji z drugimi antihipertenzivi, se zatiranje negativne povratne informacije nevtralizira, kar povzroči zmanjšanje aktivnosti renina v plazmi (pri bolnikih z arterijsko hipertenzijo v povprečju za 50-80%), pa tudi ravni antitenzina I in II. Po prvem odmerku ni hipotenzivne reakcije (učinek prvega odmerka) in refleksnega povečanja srčnega utripa kot odgovor na vazodilatacijo.
Farmakokinetika. Po peroralni uporabi je čas za doseganje največje koncentracije aliskirena v krvni plazmi 1-3 ure, absolutna biološka uporabnost je 2,6%. Hkratni vnos hrane nima pomembnega vpliva na farmakodinamiko zdravila. Zato se lahko aliskiren uporablja ne glede na vnos hrane. Aliskiren se zmerno veže na beljakovine v plazmi (47-51 %), ne glede na koncentracijo. Razpolovni čas aliskirena je 40 ur (variira od 34 do 41 ur). Izloča se večinoma nespremenjen skozi črevesje (91 %). Približno 1,4 % zaužitega odmerka se presnovi s sodelovanjem izoencima CYP3A4. Po peroralni uporabi se približno 0,6 % aliskirena izloči preko ledvic. Pri uporabi aliskirena pri bolnikih, starejših od 65 let, prilagajanje odmerka ni potrebno. Farmakokinetika aliskirena se pri bolnikih z blago do zmerno okvaro jeter (5-9 točk po Child-Pughovi lestvici) ne spremeni bistveno.
Interakcije z zdravili. Verjetnost medsebojnega delovanja aliskirena z drugimi zdravili je majhna. Pri uporabi aliskirena z enim od naslednjih zdravil se lahko njegova Cmax ali AUC spremeni: valsartan (28-odstotno zmanjšanje), metformin (28-odstotno zmanjšanje), amlodipin (29-odstotno povečanje). , cimetidin (19 % povečanje). Ker so eksperimentalne študije pokazale, da ima P-glikoprotein (membranski prenašalec molekul) pomembno vlogo pri uravnavanju absorpcije in porazdelitve aliskirena, se lahko farmakokinetika slednjega spremeni, če se uporablja sočasno s snovmi, ki zavirajo P-glikoprotein (odvisno od stopnja inhibicije). Ni pomembnega medsebojnega delovanja aliskirena s šibko ali zmerno aktivnimi zaviralci glikoproteina P, kot so atenolol, digoksin, amlodipin in cimetidin. Pri sočasni uporabi z aktivnim zaviralcem P-glikoproteina atorvastatinom (v odmerku 80 mg/dan) se v stanju dinamičnega ravnovesja AUC in Cmax aliskirena (odmerek 300 mg/dan) povečata za 50 %. Pri sočasnem jemanju aktivnega zaviralca P-glikoproteina ketokonazola (200 mg) in aliskirena (300 mg) opazimo povečanje Cmax slednjega za 80%. V eksperimentalnih študijah je sočasna uporaba aliskirena in ketokonazola povzročila povečanje absorpcije slednjega iz prebavil in zmanjšanje njegovega izločanja v žolč. Spremembe plazemske koncentracije aliskirena pri sočasni uporabi s ketokonazolom ali atorvastatinom so pričakovane znotraj koncentracijskega območja, določenega s podvojitvijo odmerka aliskirena. Nadzorovane klinične študije so dokazale varnost aliskirena v odmerku 600 mg in podvojitvi največjega priporočenega terapevtskega odmerka. Pri uporabi aliskirena skupaj s ketokonazolom ali atorvastatinom prilagoditev odmerka aliskirena ni potrebna. Pri uporabi s tako zelo aktivnim zaviralcem P-glikoproteina, kot je ciklosporin (200 in 600 mg), so zdravi posamezniki pokazali povečanje Cmax ali AUC aliskirena (75 mg) za 2,5-krat oziroma 5-krat (uporaba aliskirena ni priporočljiva). sočasno s ciklosporinom). Pri sočasni uporabi aliskirena s furosemidom so opazili zmanjšanje AUC in Cmax furosemida za 28 % oziroma 49 %. Da bi preprečili morebitno zastajanje tekočine pri predpisovanju aliskirena skupaj s furosemidom na začetku in med zdravljenjem, je treba odmerek furosemida prilagoditi glede na klinični učinek. Aliskiren je treba uporabljati previdno sočasno s kalijevimi solmi, diuretiki, ki varčujejo s kalijem, nadomestki kuhinjske soli, ki vsebujejo kalij, ali drugimi zdravili, ki lahko povečajo koncentracijo kalija v krvi.
Stranski učinek. Iz prebavnega sistema: pogosto - driska. Dermatološke reakcije: včasih - kožni izpuščaj Iz laboratorijskih parametrov: redko - rahlo znižanje koncentracije hemoglobina in hematokrita (v povprečju za 0,05 mmol / l oziroma 0,16%), kar ni zahtevalo prekinitve zdravljenja, rahlo povečanje. koncentracije kalija v krvnem serumu (0,9 % v primerjavi z 0,6 % pri placebu). Alergijske reakcije: v nekaterih primerih - angioedem.
Kontraindikacije in omejitve. Kontraindikacije: otroci in mladostniki, mlajši od 18 let, nosečnost, dojenje (dojenje), preobčutljivost za aliskiren. Kontraindicirano za uporabo med nosečnostjo in dojenjem (dojenje).
Učinkovitost in varnost aliskirena pri bolnikih s hudo okvaro jeter (več kot 9 točk po Child-Pughovi lestvici) nista bili dokazani.
Učinkovitost in varnost aliskirena nista bili dokazani: pri bolnikih s hudo okvarjenim delovanjem ledvic (serumski kreatinin >150 µmol/l za ženske in >177 µmol/l za moške in/ali hitrost glomerulne filtracije manj kot 30 ml/min), z nefrotskim sindromom, renovaskularno hipertenzijo in med rednimi postopki hemodialize.
Alisikiren je treba uporabljati previdno pri bolnikih z enostransko ali obojestransko stenozo ledvične arterije ali stenozo arterije solitarne ledvice, sladkorno boleznijo, zmanjšanim volumnom krvi, hiponatremijo, hiperkalemijo ali bolnikih po presaditvi ledvice.
Učinkovitost in varnost aliskirena nista bili dokazani: pri bolnikih s hudo okvarjenim delovanjem ledvic (serumski kreatinin >150 µmol/l za ženske in >177 µmol/l za moške in/ali hitrost glomerulne filtracije manj kot 30 ml/min), z nefrotskim sindromom, renovaskularno hipertenzijo in med rednimi postopki hemodialize, pa tudi pri bolnikih s hudo disfunkcijo jeter (več kot 9 točk po Child-Pughovi lestvici), pri bolnikih z enostransko ali dvostransko stenozo ledvične arterije ali stenozo ledvične arterije enojna ledvica.
Pri bolnikih s sladkorno boleznijo so med zdravljenjem z aliskirenom v kombinaciji z zaviralcem ACE opazili povečanje pogostnosti hiperkaliemije (5,5 %). Pri uporabi aliskirena in drugih zdravil, ki vplivajo na RAAS, pri bolnikih s sladkorno boleznijo je treba redno spremljati elektrolitsko sestavo krvne plazme in delovanje ledvic.
Med zdravljenjem z aliskirenom je možno zvišanje koncentracije kalija, kreatinina in dušika sečnine v krvi, kar je značilno za zdravila, ki vplivajo na RAAS. Na začetku zdravljenja z aliskirenom pri bolnikih z zmanjšanim volumnom krvi in/ali hiponatremijo (vključno z visokimi odmerki diuretikov) je možna simptomatska arterijska hipotenzija. Pred uporabo je treba popraviti vodno-solno neravnovesje. Pri bolnikih z zmanjšanim volumnom krvi in/ali hiponatremijo je treba zdravljenje izvajati pod natančnim zdravniškim nadzorom.
Renin-angiotenzin-aldosteronski sistem igra ključno vlogo pri uravnavanju krvnega tlaka in vodno-elektrolitnega ravnovesja. Neposredni zaviralec renina, aliskiren, zmanjša aktivnost renina v plazmi in ima kardio- in nefroprotektivne učinke. Antihipertenzivni učinek ni odvisen od spola, rase, starosti ali indeksa telesne mase. Antihipertenzivni učinek aliskirena in zaviralcev angiotenzinske konvertaze, zaviralcev receptorjev angiotenzina II in kalcijevih antagonistov je primerljiv. Aliskiren je učinkovit pri bolnikih z debelostjo, sladkorno boleznijo, okvarjenim delovanjem ledvic in presnovnim sindromom.
Neposredni zaviralci renina - aliskiren pri zdravljenju arterijske hipertenzije
Sistem renin-angiotenzin-aldosteron ima ključno vlogo pri uravnavanju krvnega tlaka ter ravnovesja tekočin in elektrolitov. Neposredni zaviralec renina - aliskiren, zmanjša aktivnost renina v plazmi, zagotavlja kardio- in nefroprotektivne učinke. Antihipertenzivni učinek je neodvisen od spola, rase, starosti, indeksa telesne mase. Antihipertenzivni učinek aliskirena in zaviralcev angiotenzinske konvertaze, blokatorjev receptorjev angiotenzina II, kalcijevih antagonistov je primerljiv. Aliskiren je učinkovit pri bolnikih z debelostjo, sladkorno boleznijo, ledvično disfunkcijo in presnovnim sindromom.
Med preučevanjem sistema renin-angiotenzin-aldosteron (RAAS) so bili razviti pristopi za uravnavanje njegove farmakološke aktivnosti. Prva komponenta RAAS, renin, je bila identificirana pred 110 leti. Kasneje je bil dokazan njegov pomen pri uravnavanju aktivnosti RAAS v patoloških stanjih, kar je postalo osnova za razvoj neposrednih zaviralcev renina (DRI). RAAS ima ključno vlogo pri uravnavanju krvnega tlaka (BP) ter ravnovesja vode in elektrolitov. Povečana aktivnost RAAS ima pomembno vlogo pri nastanku in napredovanju arterijske hipertenzije (AH), kroničnega srčnega popuščanja (KSP), kronične ledvične bolezni in sistemske ateroskleroze. RAAS je neposredno vpleten v procese rasti in diferenciacije tkiv, modulacijo vnetja in apoptoze ter potenciranje sinteze in izločanja številnih nevrohumoralnih substanc. Glavni učinki RAAS se izvajajo preko angiotenzina II (ATII) s stimulacijo specifičnih receptorjev. Aktivacija angiotenzinskega receptorja podtipa 1 (AT1) vodi do vazokonstrikcije in spodbuja sproščanje vazopresina, aldosterona, endotelina in norepinefrina. Fiziološka vloga drugih podtipov angiotenzinskih receptorjev (AT3, AT4 in ATx) se še naprej preučuje. ATII spodbuja kopičenje kolagenskega matriksa, proizvodnjo citokinov, adhezivnih molekul, aktivacijo znotrajceličnega signalnega sistema, povečano izražanje genov fetalnega fenotipa, igra pomembno vlogo pri remodeliranju miokarda in hipertrofiji levega prekata (LV), ATII je vključen v procese arterijskega preoblikovanja, intenzificiranje oksidativnega stresa in apoptoze, pospešuje nastanek in napredovanje hipertenzije, CHF, aterosklerotične poškodbe žil, diabetične in nediabetične nefropatije, angiopatije pri sladkorni bolezni (DM), eklampsije pri nosečnicah, Alzheimerjeve bolezni. Napredovanje bolezni srca in ožilja ni odvisno od vazopresorskega učinka ATII.
Izločanje renina je prvi korak pri povečanju sinteze ATI, ATII in drugih produktov kaskade RAAS. Izvajanje poznejših učinkov RAAS je modulirano z vplivom renina na specifične receptorje, kar povzroči povečanje ATII.
Do nedavnega so obstajali naslednji zaviralci RAAS - zaviralci angiotenzinske konvertaze (ACEI) in zaviralci receptorjev ATII (ARB). Mehanizem delovanja zaviralcev ACE je naslednji: aktivnost ACE je potlačena, kar vodi do zmanjšanja učinkov ATII in upočasnitve razgradnje vazopresorjev (bradikinina in prostaglandina E 2). ARB kompetitivno zavirajo receptorje ATII in zmanjšujejo učinke ATII. Receptorji za renin in prorenin se nahajajo na površini celice. Aktivacija celične signalne poti z reninom povzroči fibrozo in celično hipertrofijo. V zadnjih letih se nadzor nad aktivnostjo RAAS izvaja z omejevanjem proizvodnje ATII, blokiranjem ATII in receptorjev za aldosteron, z omejevanjem izločanja renina, predvsem z uporabo zaviralcev beta. Številne študije so pokazale, da je ustrezno zmanjšanje aktivnosti RAAS s pomočjo zaviralcev ACE, ARB ali aldosterona bolj domnevno kot dejansko doseženo, saj se razvije pojav "pobega" antihipertenzivnih in organoprotektivnih učinkov zaviralcev RAAS z njihovo dolgotrajno uporabo. . Za premagovanje tega pojava se uporabljajo kombinacije ACEI + ARB, ACEI + β-blokator, ACEI + spironolakton. Pojav PIR se obravnava kot način za doseganje popolnejšega nadzora nad aktivnostjo RAAS in premagovanje fenomena "pobega".
Prvi PIR so bili sintetizirani v 70. letih dvajsetega stoletja, vendar je bilo prvo zdravilo, primerno za peroralno uporabo, aliskiren (A). A. z vezavo na aktivni del tarčne molekule preprečuje njeno interakcijo z angiotenzinogenom. Z zmanjšanjem aktivnosti renina v plazmi (PRA) ima A. kardio- in nefroprotektivne učinke. Zaviralci RAAS stimulirajo ARP, kar ima za posledico naslednje učinke: vazokonstrikcija v glomerulih, vnetje, fibroza (ledvice); hipertrofija, fibroza, vazokonstrikcija (srce); hiperplazija, hipertrofija, vnetje, oksidacija lipidov, fibroza (vaskularna); vazokonstrikcija (možgani). A. deluje na točki aktivacije RAAS in zmanjša ARP. Za razliko od zaviralcev ACE in ARB A zmanjša raven ATI, AII in ARP. Renin ima encimsko in receptorsko delovanje.
Farmakokinetika A. Klinične študije so pokazale, da je prenašanje A primerljivo s placebom. Trajanje delovanja tega zdravila je več kot 24 ur, ledvična vazodilatacija pa lahko traja do 48 ur. Razpolovni čas A je približno 40 ur, kar omogoča odmerjanje enkrat na dan. Priporočeni začetni odmerek A je 150 mg z nadaljnjim povečanjem na 300 mg. Farmakokinetične značilnosti A niso odvisne od glikemije na tešče in koncentracije glikoziliranega hemoglobina v krvni plazmi. Izločanje zdravila poteka nespremenjeno z žolčem, izločanje z urinom<1%. Исследования первой и второй фазы показали, что препарат способствует эффективной блокаде РААС и дозозависимому предотвращению повышения уровня АД . Полный антигипертензивный эффект наступает через 2 недели и не зависит от пола, расы, возраста, индекса массы тела. А обладает минимальным риском лекарственных взаимодействий, не требует коррекции дозы при хронической почечной недостаточности (ХПН), при поражении печени. Добавление А к ловастатину, атенололу, варфарину, фуросемиду, дигоксину, целекоксибу, гидрохлоротиазиду (ГХТЗ), рамиприлу, валсартану, метформину и амлодипину не приводило к клинически значимому увеличению экспозиции А. Совместное его применение с аторвастатином приводило к 50% увеличению Cmax (максимальная концентрацию препарата) и AUC (площадь под кривой «концентрация - время») после приема нескольких доз. Совместное применение 200 мг кетоконазола 2 раза в день с А приводило к 80% увеличению уровня А в плазме. При совместном применении А с фуросемидом AUC и Cmax фуросемида снижались на 30 и 50% соответственно . Не требуется коррекции дозы А у пациентов с ХПН. У пациентов с ХПН отмечается умеренное (~двухкратное) увеличение экспозиции А, но оно не коррелировало с тяжестью поражения почек и клиренсом креатинина. Клиренс А составлял 60–70 % у здоровых. Почечный клиренс А уменьшался с увеличением тяжести поражения почек. Поскольку поражение почек оказывает только умеренное влияние на экспозицию А, то коррекция дозы А, скорее всего, не требуется у пациентов с гипертензией и поражением почек. Не требуется коррекции дозы А и у пациентов поражением печени. Не было отмечено достоверной корреляции между экспозицией А и тяжестью поражения печени. А способен осуществлять блокаду РААС, что приводит к снижению сосудистого тонуса и системного АД. Однако препарат не лишен и негативных качеств, связанных с феноменом «ускользания», что характерно для всех лекарственных средств, блокирующих активность РААС. Снижение эффективности А вследствие восстановления секреции ренина или наличия синдрома отмены не подтверждается клиническими наблюдениями .
Antihipertenzivna učinkovitost A. ARP je indikator, potreben ne le za diagnozo redkih sekundarnih oblik hipertenzije (renovaskularne). Klinični in prognostični pomen ARP je naslednji: indikator se poveča s hipertenzijo v kombinaciji z drugimi dejavniki tveganja (moški spol, kajenje, sladkorna bolezen tipa 2, debelost, presnovni sindrom) in ob prisotnosti poškodbe ciljnih organov (TOD) ( obstojna zmanjšanje hitrosti glomerularne filtracije); zvišanje ARP renina je lahko iatrogeno, izzovejo ga zaviralci ACE in/ali diuretiki (enkalna zanka, tiazid), kar povzroči izgubo natrija skozi ledvice: v tem primeru opazimo nadaljnjo aktivacijo RAAS, kar povzroči izgubo nadzora nad krvnim tlakom in napredovanje CHF; zvišanje ARP je vedno nagnjenost k poslabšanju POM in potencialno smrtnim kardiovaskularnim zapletom (KVB) in ledvičnim zapletom; Povečan ARP je neodvisen dejavnik farmakoloških učinkov PIR, ki omogoča doseganje znižanja krvnega tlaka in zaviranje napredovanja POM. A. lahko velja za učinkovito antihipertenzivno zdravilo v monoterapiji in v kombinaciji z drugimi zdravili. Indikacije za uporabo PIR so: hiperreninske variante hipertenzije, normoreninska hipertenzija, pri kateri prorenin in posredna aktivacija proreninskih receptorjev vodi do destrukcije tkiva. PIR ni indiciran samo za renovaskularno hipertenzijo in CHF, ampak tudi za povečane plazemske koncentracije prorenina (hipertenzija s hiperaktivacijo simpatičnega živčnega sistema, metabolični sindrom, sladkorna bolezen tipa 2, menopavza).
Monoterapija A. zagotavlja od odmerka odvisno znižanje diastoličnega krvnega tlaka (DBP) in sistoličnega krvnega tlaka (SBP) pri bolnikih z blago in zmerno hipertenzijo. Ocena učinkovitosti in varnosti A. pri 672 bolnikih s hipertenzijo stopnje I-II v 8-tedenski s placebom nadzorovani študiji je pokazala od odmerka odvisno zmanjšanje SBP in DBP. Antihipertenzivni učinek A je trajal dva tedna po njegovi prekinitvi; A je bil dobro prenašan; incidenca neželenih učinkov se ni razlikovala od placeba. A - trgovsko ime rasilez (P) - v odmerku 150 mg zmanjša SBP za 13 mm Hg. Art., DBP pa za 10,3 mm Hg. Art., In v odmerku 300 mg zmanjša SBP s 15 na 22 mm Hg. Umetnost. (odvisno od stopnje hipertenzije) in DBP - za 11 mm Hg. Umetnost. In zagotavlja nadzor krvnega tlaka zgodaj zjutraj. Po preklicu A se pojav "odboja" ne pojavi. Združena analiza kliničnih preskušanj, ki vključuje 8481 bolnikov. ki so prejemali monoterapijo A ali placebo, je pokazala, da je enkratni odmerek A v odmerku 150 ali 300 mg/dan povzročil znižanje SBP za 12,5 in 15,2 mm Hg. Umetnost. v primerjavi z zmanjšanjem za 5,9 mm Hg. Umetnost. pri bolnikih, ki so prejemali placebo (str<0,0001). ДАД снижалось на 10,1 (на дозе 150 мг) и 11,8 мм рт. ст. (на дозе 300 мг) соответственно (в группе плацебо - на 6,2 мм рт. ст., р<0,0001). Различий в антигипертензивном эффекте А у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено. При применении иАПФ увеличиваются концентрации проренина и АРП (снижается эффективность иАПФ). При увеличении дозы иАПФ достоверно нарастает АРП и плазменная концентрация АТI . Исследование А в сравнении с иАПФ у пациентов с мягкой и умеренной АГ установило следующее: А достоверно больше снижает ДАД и САД, чем рамиприл через 12 недель лечения (монотерапия). А ± гидрохлортиазид (ГХТЗ) достоверно больше снижает ДАД и САД, чем рамиприл ± ГХТЗ через 26 недель лечения. А достоверно больше снижает ДАД и САД, чем рамиприл через 12 недель лечения (монотерапия) у пациентов с АГ II ст. Терапия А обеспечивает достоверно лучший контроль АД по сравнению с рамиприлом. САД и ДАД возвращаются к исходному уровню более быстро после отмены рамиприла, чем после отмены А. Сравнение гипотензивной эффективности А, ирбесартана и рамиприла после пропущенной дозы показало следующее: после пропущенной дозы достигнутое снижение АД было достоверно больше в группе А., чем в группе рамиприла . Достоверно больший процент снижения АД поддерживается после пропущенной дозы А по сравнению с ирбесартаном или рамиприлом. Возвращение к исходному АД происходит более плавно после отмены А., чем рамиприла. А. и эналаприл почти в равной степени уменьшают плазменную концентрацию АТП, но в отличие от А прием эналаприла приводил к более чем 15-кратному росту АРП. В условиях низкосолевой диеты индуцированная А органная (в частности, почечная) вазодилатация может сохраняться до 48 часов. Провоцировать подъем АРП могут препараты, стимулирующие натрийурез (тиазидовые и петлевые диуретики). Назначение А. в этой ситуации один из наиболее действенных подходов к устранению реактивного повышения АРП при комбинации с иАПФ и тиазидовым диуретиком.
Leta 2009 so bili objavljeni rezultati multicentrične kontrolirane klinične raziskave, v kateri so primerjali učinkovitost A in HCTZ (začetno antihipertenzivno zdravljenje) pri 1124 bolnikih s hipertenzijo; po potrebi smo tem zdravilom dodali amlodipin. Ob koncu obdobja monoterapije (12. teden) je postalo jasno, da A vodi do izrazitejšega znižanja krvnega tlaka kot HCTZ (-17,4/-12,2 mmHg v primerjavi z -14,7/-10,3 mmHg Hg, r<0,001). Эти результаты важны, поскольку большинство пациентов, страдающих АГ, исходно нуждаются в комбинированной антигипертензивной терапии. Оптимизация комбинированной антигипертензивной терапии важна у пациентов с Ож. при этом у А имеются дополнительные преимущества . Больные с Ож, у которых полная (25 мг/сут) доза ГХТЗ не приводила к снижению АД, были рандомизированы на группы, которым назначали амлодипин + ГХТЗ (10/25 мг/сут), ирбесартан + ГХТЗ (300/25 мг/сут) и А. + ГХТЗ (300/25 мг/сут). По мере нарастания ст. Ож антигипертензивная эффективность схем лечения (БРА + ГХТЗ, антагонист кальция + ГХТЗ) снижается. В группе с Ож. III ст. (ИМТ≥40 кг/м 2) только у 50% удалось достичь целевого АД с помощью ирбесартана + ГХТЗ, у 43,8% - с помощью амлодипина + ГХТЗ и лишь у 16,7% - с помощью ГХТЗ. При менее выраженном (I–II ст.) Ож более чем у 40% пациентов, получавших БРА + ГХТЗ или амлодипин + ГХТЗ, и более чем у 60% больных, принимавших только ГХТЗ, целевое АД не было достигнуто. В группе пациентов с Ож. I-II ст., получавших А. + ГХТЗ, целевого АД достигли 56,7% больных, а с Ож. III ст. - 68,8%. АГ, сочетающаяся с Ож, часто ассоциируется с увеличением активности РААС и трудно корригируется, поэтому в таких случаях может быть назначен А.
Ugotovljena je bila sposobnost A. za znižanje krvnega tlaka in zmanjšanje albuminurije. V študiji AVOID so pri 599 bolnikih z diabetično nefropatijo s hipertenzijo ocenili učinek kombinacije največjih odmerkov losartana in A na albuminurijo (merjeno z razmerjem albumin/kreatinin v urinu). Dodatek A (300 mg/dan) k losartanu (100 mg/dan) je spremljalo znatno zmanjšanje razmerja albumin/kreatinin v urinu za 20 % v celotni skupini (100 %) in pri 24,7 % - za 50 % ali več. V skupini, ki je prejemala losartan + placebo, je bilo zmanjšanje razmerja albumin/kreatinin v urinu za 50 % ali več doseženo le pri 12,5 % bolnikov (p<0,001). ПИР могут уменьшить альбуминурию как в режиме монотерапии, так и при комбинации с БРА, позволяющей достичь оптимальной ст. блокады РААС, обеспечивающей устранение генерализованной и локально-почечной дисфункции эндотелия.
In s kombinirano terapijo hipertenzije. Pri bolnikih z blago in zmerno hipertenzijo brez in z debelostjo. A. + HCTZ zagotavljajo znatno znižanje DBP in SBP. Več bolnikov doseže kontrolo krvnega tlaka s kombinacijo A + HCTZ kot z drugimi kombinacijami HCTZ. Pri bolnikih s hipertenzijo in sladkorno boleznijo A + ramipril pomembno zniža krvni tlak kot obe komponenti monoterapije. A zagotavlja znatno boljši nadzor krvnega tlaka kot ramipril. Pri bolnikih z blago in zmerno hipertenzijo A + valsartan bistveno bolje zniža krvni tlak kot obe komponenti monoterapije. A znatno zniža krvni tlak v kombinaciji z amlodipinom v odmerku 5 mg/dan. A poveča raven nadzora krvnega tlaka v primerjavi z amlodipinom v odmerku 5 mg/dan. A. ± HCTZ so učinkoviti pri dolgotrajni terapiji hipertenzije. A + valsartan ± HCTZ zagotavljajo dolgoročno antihipertenzivno učinkovitost (vmesna analiza 6 mesecev zdravljenja).
Leta 2009 je bil objavljen načrt študije ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardio-Renal Endpoints) (del programa ASPIRE HIGHER), ki je preučevala učinek dvojne blokade RAAS s kombinacijo A in standardnega (ACEI ali ARB) pri bolnikih s sladkorno boleznijo tipa 2 z visokim tveganjem za srčno-žilne zaplete in ledvične zaplete, deloma zaradi povečanja ARP. Primarni cilj te študije je oceniti učinkovitost dodajanja A k standardni terapiji na učinek na sestavljeno končno točko (srčno-žilna smrt in zapleti: uspešno oživljanje, neusodni MI, neusodna možganska kap, nenačrtovana hospitalizacija zaradi CHF; razvoj končne odpovedi ledvic, podvojitev serumskega kreatinina, smrt zaradi vzrokov, povezanih z okvaro ledvic). Ta študija naj bi trajala približno 4 leta, njeni rezultati pa naj bi upravičili uporabo kombinacije A. z zaviralcem ACE ali ARB za zaviranje napredovanja kardiorenalnega sindroma pri sladkorni bolezni tipa 2. Največjo učinkovitost A lahko pričakujemo pri tistih različicah hipertenzije, pri katerih obstaja težnja k povečanju ARP (tvorjenje esencialne hipertenzije, debelosti, presnovnega sindroma, sladkorne bolezni tipa 2, kronične odpovedi ledvic). Velika večina bolnikov s hipertenzijo potrebuje kombinirano antihipertenzivno terapijo že v prvi fazi zdravljenja in, kot je pokazala ena od nedavno objavljenih kliničnih študij, v sklopu kombinacij A ohranja svojo aktivnost ne glede na začetni ARP. Zvišanje ARP pri bolnikih s hipertenzijo velja za diagnostični marker in neodvisen dejavnik tveganja za potencialno smrtne srčno-žilne dogodke. Farmakološka modulacija ARP je eden najbolj obetavnih pristopov k obvladovanju tveganja za srčno-žilne dogodke pri bolnikih s hipertenzijo v kombinaciji z okvaro ledvic, presnovnim sindromom in debelostjo. . Študija AVOID (Aliskiren in eValuation of Proteinuria In Diabetes) (del programa ASPIRE HIGHER) je bila zasnovana za ovrednotenje potenciala določenega antihipertenzivnega zdravila pri zaščiti končnih organov v različnih situacijah, za katere je značilno zelo veliko tveganje za morebitne smrtne zaplete ( Hipertrofija LV, diabetes tipa 2, CHF). Vmesni rezultati kažejo, da je neposredna blokada renina z A ena najbolj dostopnih strategij za izboljšanje dolgoročne prognoze. V študiji ALLAY (Aliskiren Left Ventricular Assessment of Hypertrophy) je A pri bolnikih s hipertenzijo in prekomerno telesno težo povzročil zmanjšanje indeksa miokardne mase LV, kar odraža regresijo njegove hipertrofije. Kombinacija A in losartana je zagotovila nadaljnje zmanjšanje indeksa miokardne mase LV za dodatnih 20 % v primerjavi z monoterapijo z losartanom, vendar ta razlika ni dosegla statistično značilne vrednosti. Glede na rezultate študije ALOFT (ALiskiren Observation of Heart Failure Treatment study) je dodatek A standardnemu režimu zdravljenja kongestivnega srčnega popuščanja z znaki neugodne prognoze (vztrajno zvišanje plazemske koncentracije natriuretičnega peptida) in hipertenzije omogočil za nadaljnje izboljšanje razmerja velikosti mitralne regurgitacije glede na površino mitralne odprtine in transmitralni pretok krvi. Zahvaljujoč A je bilo mogoče doseči zmanjšanje koncentracije markerjev maladaptivne nevrohumoralne aktivacije (plazemske ravni možganskega natriuretičnega peptida in njegovega N-aminoterminalnega prekurzorja (NT-pro BNP), koncentracija aldosterona v urinu, ARP). Možnosti uporabe A za zaviranje razvoja ledvične okvare so določene z visoko varnostjo, ki je očitno bistveno boljša od drugih zaviralcev RAAS (zaviralci ACE, ARB in antagonisti aldosterona) zaradi manjšega tveganja za povečanje kreatininemije in kalemije. Izločen predvsem z žolčem in ne z urinom, A ohrani svoj antihipertenzivni učinek, vendar ne povzroči poslabšanja ledvične funkcije pri bolnikih s trajnim zmanjšanjem hitrosti glomerularne filtracije. Prav v nefrologiji je lahko agresivna blokada RAAS s sočasno uporabljenimi več razredi zdravil učinkovita pri preprečevanju terminalne kronične odpovedi ledvic. A zmanjša albuminurijo (znatno boljše od monoterapije z vsakim zdravilom) in verjetnost nepopravljivega poslabšanja ledvične funkcije v skupini bolnikov (s proteinurijo > 1 g/dan), kot je prikazano v študiji COOPERATE (COkombinirano zdravljenje receptorja angiotenzina II blokator in zaviralec angiotenzinske konvertaze pri nediabetični bolezni ledvic). Študija ONTARGET (OngoiNg Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) je pokazala, da je kombinacija ACEI in ARB povezana z večjo verjetnostjo arterijske hipotenzije in hiperkaliemije ter v primerjavi z monoterapijo s temi zdravili povezana s povečanjem v hitrosti uvedbe programa hemodialize in podvojitev kreatininemije pri bolnikih z visokim tveganjem in POM. Naslednje klinične situacije so lahko predmet dokazovanja nefroprotektivnih lastnosti A.: hipertenzija/metabolični sindrom ali sladkorna bolezen tipa 2 z albuminurijo; Hipertenzija, povezana z vztrajnim zmanjšanjem hitrosti glomerularne filtracije; Hipertenzija pri kroničnih boleznih ledvic z in brez proteinurije (vključno z nefrotično) (na primer tubulointersticijske nefropatije); renovaskularna hipertenzija različnega izvora; bolniki, pri katerih se je zaradi različnih razlogov povečala kreatininemija ali hiperkalemija pri uporabi zaviralcev ACE ali ARB; terminalna kronična odpoved ledvic, vključno s tistimi, zdravljenimi s programsko hemodializo ali kontinuirano ambulantno peritonealno dializo; prejemniki presajene ledvice.
Nov razred antihipertenzivnih zdravil (ADM) zahteva dodatne raziskave za povečanje števila dokazov o upočasnitvi napredovanja POM.
In očitno je, da je indiciran za večino kategorij bolnikov s hipertenzijo, in ta okoliščina se odraža v ruskih priporočilih o hipertenziji za diagnozo in zdravljenje hipertenzije (četrta revizija, 2010) kot dodaten razred antihipertenzivnih zdravil za kombinirano zdravljenje. Z razvojem okvare ledvic je A lahko učinkovit pri preprečevanju terminalne kronične odpovedi ledvic in izboljšanju prognoze teh bolnikov.
NA. Andrejčev, Z.M. Galeeva
Kazanska državna medicinska univerza
Andreičev Nail Aleksandrovič - kandidat medicinskih znanosti, izredni profesor Oddelka za fakultetno terapijo in kardiologijo
Literatura:
1. Bauer J.H., Reams G.P. Antagonisti receptorjev angiotenzina II tipa 1. Nov razred antihipertenzivnih zdravil // Arch. Pripravnik. Med. - 1995. - Letn. 155 (13). - R. 1361-1368.
2. Kim S., Iwao H. Molekularni in celični mehanizmi kardiovaskularnih in ledvičnih bolezni, ki jih povzroča angiotenzin II // Pharmacol. Rev. - 2000. - letn. 52(1). - R. 11-34.
3. Brown M. J. Aliskiren // Naklada. - 2008. - Letn. 118(7). - R. 773-784.
4. Nguyen G., Delarue F., Burckle C. et al. Osrednja vloga receptorja renin/prorenin pri proizvodnji angiotenzina II in celičnih odzivih na renin // Clin. Investirajte. - 2002. - letn. 109(11). - R. 1417-1427.
5. Nussberger J., Wuerzner G., Jensen C. et al. Zaviranje angiotenzina II pri ljudeh s peroralno aktivnim zaviralcem renina aliskirenom (SPP100): primerjava z enalaprilom // Hipertenzija. - 2002. - letn. 39(1). - R. 1-8.
6. Zhao C., Vaidyanathan S., Dieterich H. A. et al. Ocena farmakokinetične interakcije med peroralnim direktnim zaviralcem renina aliskirenom in furosemidom: študija pri zdravih prostovoljcih // Clin. Pharmacol. Ther. - 2007. - letn. 81 (dodatek 1). - S. 110 (PIII-78).
7. Gradman A.H., Kad R. Inhibicija renina pri hipertenziji // Am. Coll. kardiol. - 2008. - Letn. 51(5). - S. 519-528.
8. Oh B.-H., Mitchell J., Herron J.R. et al. Aliskiren, peroralni zaviralec renina, zagotavlja od odmerka odvisno učinkovitost in trajno 24-urno kontrolo krvnega tlaka pri bolnikih s hipertenzijo // Am. Coll. kardiol. - 2007. - letn. 49. - S. 1157-1163.
9. Fisher N.D., Jan Danser A.H., Nussberger J. et al. Ledvični in hormonski odzivi na neposredno inhibicijo renina z aliskirenom pri zdravem človeku // Cirkulacija. - 2008. - Letn. 117 (25). - S. 3199-3205.
10. Dahlo F.B., Anderson D.R., Arora V. et al. Aliskiren, neposredni zaviralec renina, zagotavlja antihipertenzivno učinkovitost in odlično prenašanje neodvisno od starosti ali spola pri bolnikih s hipertenzijo (povzetek) // Clin. Hipertenzija. - 2007. - letn. 9 (Dodatek A). - S. A157.
11. Andersen K., Weinberger M.H., Egan B. et al. Primerjalna učinkovitost in varnost aliskirena, peroralnega neposrednega zaviralca renina, in ramiprila pri hipertenziji: 6-mesečno, randomizirano, dvojno slepo preskušanje // Hipertenzija. - 2008. - Letn. 26. - S. 589-599.
12. Schmieder R.E., Philipp T., Guerediaga J. et al. Dolgoročna antihipertenzivna učinkovitost in varnost peroralnega neposrednega zaviralca renina aliskirena. 12-mesečno randomizirano, dvojno slepo primerjalno preskušanje s hidroklorotiazidom // Circulation. - 2009. - letn. 119. - S. 417-425.
13. Prescott M.F., Boye S.W., Le Breton S. et al. Antihipertenzivna učinkovitost neposrednega zaviralca renina aliskirena ob dodajanju zdravljenja s hidroklorotiazidom pri bolnikih z ekstremno debelostjo in hipertenzijo // Am. Coll. kardiol. - 2007. - letn. 49(9, dodatek A). - S. 370A. - (Str. 1014-169).
14. Persson F., Rossing P., Schjoedl K.J. et al. Časovni potek antiproteinuričnih in antihipertenzivnih učinkov neposredne inhibicije renina pri sladkorni bolezni tipa 2 // Kidney Int. - 2008. - Letn. 73 (12). - S. 1419-1425.
15. Parving H.H., Persson F., Lewis J.B. et al. IZOGIBAJTE SE raziskovalcem študije. Aliskiren v kombinaciji z losartanom pri sladkorni bolezni tipa 2 in nefropatiji // N. Engl. J. Med. - 2008. - Letn. 358(23). - S. 2433-2446.
16. Jordan J., Engli S., Boye S.W. et al. Neposredna inhibicija renina z aliskirenom pri debelih bolnikih z arterijsko hipertenzijo // Hipertenzija. - 2007. - letn. 49. - S. 1-9.
17. Uresin Y., Taylor A., Kilo C. et al. Učinkovitost in varnost neposrednega zaviralca renina aliskirena in ramiprila samega ali v kombinaciji pri bolnikih s sladkorno boleznijo in hipertenzijo // Renin. Angiotenzin aldosteron sist. - 2007. - letn. 8. - S. 190-198.
18. Oparil S., Yarrows S., Patel S. et al. Učinkovitost in varnost kombinirane uporabe aliskirena in valsartana pri bolnikih s hipertenzijo: randomizirano, dvojno slepo preskušanje // Lancet. - 2007. - letn. 370. - S. 221-229.
19. Drummond W., Munger M.A., Essop M.R. et al. Antihipertenzivna učinkovitost peroralnega neposrednega zaviralca renina aliskirena kot dodatnega zdravljenja pri bolnikih, ki se ne odzovejo na monoterapijo z amlodipinom // Clin. Hipertenzija. - 2007. - letn. 9. - S. 742-750.
20. Chrysant S.G., Murray A.V., Hoppe U.C. et al. Dolgoročna varnost, prenašanje in učinkovitost aliskirena v kombinaciji z valsartanom pri bolnikih s hipertenzijo: 6-mesečna vmesna analiza // Curr. Med. Res. Opin. - 2008. - Letn. 24 (4). - S. 1039-1047.
21. Preskus aliskirena pri sladkorni bolezni tipa 2 z uporabo kardiorenalnih končnih točk (ALTITUDE): utemeljitev in načrt študije // Nephrol Dial Transplant. - 2009. - Letn. 24 (5). - S. 1663-1671.
22. Stanton A.V., Dicker P., O’Brien E.T. Monoterapija z aliskirenom povzroči največje in najmanjše znižanje krvnega tlaka pri bolnikih z visoko oziroma nizko izhodiščno ravnijo PRA // Am. J. Hipertenzija. - 2009. - letn. 22. - S. 954-957.
23. Mukhin N. A., Fomin V. V. Aktivnost renina v plazmi je dejavnik tveganja in neodvisna tarča antihipertenzivne terapije: vloga aliskirena // Consilium Medicum. - T. 11. - 2009. - Št. 10. - Str. 3-6.
24. Solomon S.D., Appelbaum E., Manning W.J. et al. Učinek neposrednega zaviralca renina aliskirena, samega ali v kombinaciji z losartanom, v primerjavi z losartanom, na maso levega prekata pri bolnikih s hipertenzijo in hipertrofijo levega prekata // Preizkus ocene hipertrofije levega prekata z aliskirenom (ALLAY). Predstavljeno na American College of Cardiology. 57. letno znanstveno zasedanje, 31. marec 2008.
25. Mc. Murray J.V., Pitt B., Latini R. et al. Učinki peroralnega neposrednega zaviralca renina aliskirena pri bolnikih s simptomatskim srčnim popuščanjem // Circulation-Heart Failure. - 2008. - Letn. 1. - S. 17-24.
26. Nakao N., Yoshimura A., Morita H. et al. Kombinirano zdravljenje z zaviralcem receptorjev angiotenzina II in zaviralcem angiotenzinske konvertaze pri nediabetični ledvični bolezni (COOPERATE): randomizirano kontrolirano preskušanje // Lancet. - 2003. - Letn. 361 (9352). - S. 117-124.
27. Mann I.F., Schmieder R.E., McQueen M. et al. Ledvični izidi s telmisartanom, ramiprilom ali obema pri ljudeh z visokim tveganjem za ožilje (študija ONTARGET): multicentrično, randomizirano, dvojno slepo, kontrolirano preskušanje // Lancet. - 2008. - Letn. 372 (9638). - S. 547-553.
28. Chazova I.E., Fomin V.V., Paltseva E.M. Neposredni zaviralec renina aliskiren - nove možnosti za zaščito ledvic pri arterijski hipertenziji // Klinična nefrologija. - št. 1. - 2009. - str. 44-49.
29. Chazova I.E., Fomin V.V. Neposredni zaviralec renina aliskiren: možnosti za korekcijo kardiorenalnega sindroma // Sistemska hipertenzija. - 2009. - Št. 4. - Str. 53-58.
30. Diagnoza in zdravljenje arterijske hipertenzije: ruska priporočila // Sistemska hipertenzija. - 2010. - št. 3. - Str. 5-26.
03.07.2012
386 ogledov
Pri arterijski hipertenziji (hipertenziji) se poveča količina encima Renin v krvi. To vodi do vztrajnega in dolgotrajnega povečanja količine beljakovin Angiotenzin 2 v krvi in tkivih telesa. Angiotenzin 2 ima vazokonstriktorski učinek, spodbuja zadrževanje natrija in vode v telesu, kar vodi do zvišanja krvnega tlaka. . Dolgotrajna visoka raven angiotenzina 2 v krvi in tkivih povzroča vztrajno zvišanje krvnega tlaka, to je arterijsko hipertenzijo. Inhibitor renina je zdravilna učinkovina, ki se veže na renin, zaradi česar se renin nevtralizira in izgubi encimsko aktivnost. To medsebojno vodi do znižanja ravni angiotenzina 2 v krvi in tkivih – do znižanja krvnega tlaka.
AT2 ima vazokonstriktorski učinek, spodbuja zadrževanje natrija in vode v telesu. To vodi do povečanja in povečanja volumna krožeče krvi. Sekundarno se poveča moč srčnih kontrakcij. Vse to skupaj povzroči zvišanje krvnega tlaka, tako sistoličnega (zgornjega) kot diastoličnega (spodnjega). Višja kot je raven renina v krvi, višja kot je raven AT2 v krvi, višji je krvni tlak.
Zaporedje encimskih transformacij: renin + angiotenzinogen = angiotenzin 1 + ACE = angiotenzin 2, imenovan Sistem renin-angiotenzin (RAS) oz Sistem renin-angiotenzin-aldosteron (RAAS). Z aktivacijo (povečano aktivnostjo) RAS razumemo zvišanje ravni renina in AT2 v krvi.
Visoke ravni renina v krvi povzročijo zvišanje ravni AT2 v krvi in tkivih. Visoka raven AT2 v krvi in tkivih za dolgo časa povzroči vztrajno zvišanje krvnega tlaka, to je -.
Znižanje ravni renina v krvi medsebojno vodi do znižanja ravni AT2 v krvi in tkivih - do znižanja krvnega tlaka.
Zaviralec renina– zdravilna snov, ki se veže na renin, zaradi česar se renin nevtralizira, izgubi encimsko aktivnost in zmanjša encimsko aktivnost renina v krvi. Renin, vezan na zaviralec renina, izgubi sposobnost razgradnje angiotenzinogena v AT1. Hkrati pride do medsebojno povezanega znižanja ravni AT2 v krvi in tkivih - znižanje krvnega tlaka, zmanjšanje aktivnosti RAS, izboljšanje krvnega pretoka, prekrvitev organov in tkiv telesa. telo.
Aliskiren je prvi in trenutno edini zaviralec renina, s katerim so bile opravljene vse faze kliničnih raziskav in ga že od leta 2007 priporočajo za zdravljenje arterijske hipertenzije.
Zdravilna snov Aliskiren ki jih proizvaja farmacevtska industrija pod trgovskimi (komercialnimi) imeni:
- Rasilez v obliki preprostega zdravila, ki vsebuje samo eno zdravilno učinkovino - aliskiren;
- Co-Rasilez v obliki kombiniranega (kompleksnega) zdravila, ki vsebuje dve učinkovini: zaviralec renina aliskiren in diuretik hidroklorotiazid (saluretik, tiazidni diuretik).
Svoje ocene in komentarje o uporabi zaviralca renina aliskirena za zdravljenje arterijske hipertenzije lahko objavite spodaj.
