Para cita: Leonova M. V. Nuevos y prometedores fármacos que bloquean el sistema renina-angiotensina-aldosterona // RMJ. Revisión médica. 2013. Nº 17. S 886
El papel del sistema renina-angiotensina-aldosterona (SRAA) en el desarrollo de la hipertensión arterial (HA) y otras enfermedades cardiovasculares se considera dominante en la actualidad. En el continuo cardiovascular, la hipertensión se encuentra entre los factores de riesgo, y el principal mecanismo fisiopatológico de daño al sistema cardiovascular es la angiotensina II (ATII). ATII es un componente clave del RAAS, un efector que implementa vasoconstricción, retención de sodio, activación del sistema nervioso simpático, proliferación e hipertrofia celular, desarrollo de estrés oxidativo e inflamación de la pared vascular.
En la actualidad, ya se han desarrollado dos clases de fármacos que bloquean el RAAS y se han utilizado ampliamente clínicamente: los inhibidores de la ECA y los bloqueadores de los receptores ATII. Los efectos farmacológicos y clínicos de estas clases difieren. ACE es una peptidasa de metaloproteinasa de zinc que metaboliza ATI, AT1-7, bradicinina, sustancia P y muchos otros péptidos. El mecanismo de acción de los inhibidores de la ECA se asocia principalmente con la prevención de la formación de ATII, que promueve la vasodilatación, la natriuresis y elimina los efectos proinflamatorios, proliferativos y otros de la ATII. Además, los inhibidores de la ECA previenen la degradación de la bradicinina y aumentan su nivel. La bradicinina es un potente vasodilatador, potencia la natriuresis y, lo más importante, tiene acción cardioprotectora (previene la hipertrofia, reduce el daño isquémico del miocardio, mejora el riego sanguíneo coronario) y vasoprotectora, mejorando la función endotelial. Al mismo tiempo, un alto nivel de bradiquinina es la causa del desarrollo de angioedema, que es una de las graves desventajas de los inhibidores de la ECA, que aumentan significativamente el nivel de cininas.
Los inhibidores de la ECA no siempre pueden bloquear por completo la formación de ATII en los tejidos. Ahora se ha establecido que otras enzimas que no están asociadas con la ECA, principalmente las endopeptidasas, que no se ven afectadas por los inhibidores de la ECA, también pueden participar en su transformación en los tejidos. Como resultado, los inhibidores de la ECA no pueden eliminar por completo los efectos de la ATII, lo que puede ser la razón de su falta de eficacia.
La solución a este problema fue facilitada por el descubrimiento de los receptores ATII y la primera clase de fármacos que bloquean selectivamente los receptores AT1. A través de los receptores AT1, se realizan los efectos desfavorables de ATII: vasoconstricción, secreción de aldosterona, vasopresina, norepinefrina, retención de líquidos, proliferación de células de músculo liso y cardiomiocitos, activación de SAS, así como el mecanismo de retroalimentación negativa: la formación de renina. . Los receptores AT2 realizan funciones "beneficiosas", como vasodilatación, procesos de reparación y regeneración, acción antiproliferativa, diferenciación y desarrollo de tejidos embrionarios. Los efectos clínicos de los bloqueadores de los receptores ATII están mediados por la eliminación de los efectos "nocivos" de la ATII a nivel de los receptores AT1, lo que proporciona un bloqueo más completo de los efectos adversos de la ATII y un aumento del efecto de la ATII sobre los receptores AT2. , que complementa los efectos vasodilatadores y antiproliferativos. Los bloqueadores de los receptores ATII tienen un efecto específico sobre el SRAA sin interferir con el sistema de cininas. La falta de influencia sobre la actividad del sistema de cininas, por un lado, reduce la gravedad de los efectos indeseables (tos, angioedema), pero, por otro lado, priva a los bloqueadores de los receptores ATII de un importante efecto antiisquémico y vasoprotector. que los distingue de los inhibidores de la ECA. Por esta razón, las indicaciones para el uso de bloqueadores de los receptores ATII en la mayoría repiten las indicaciones para el nombramiento de inhibidores de la ECA, lo que los convierte en medicamentos alternativos.
A pesar de la introducción de los bloqueadores del RAAS en la práctica generalizada del tratamiento de la hipertensión, persisten los problemas para mejorar los resultados y el pronóstico. Estos incluyen: la posibilidad de mejorar el control de la presión arterial en la población, la efectividad del tratamiento de la hipertensión resistente, la posibilidad de reducir aún más el riesgo de enfermedad cardiovascular.
La búsqueda de nuevas formas de influir en la RAAS continúa activamente; se están estudiando otros sistemas que interactúan estrechamente y se están desarrollando fármacos con múltiples mecanismos de acción, como inhibidores de la ECA y de la endopeptidasa neutra (NEP), inhibidores de la enzima convertidora de endotelina (EPF) y de la NEP, inhibidores de la ACE/NEP/EPF.
Inhibidores de la vasopeptidasa
Además de la conocida ACE, las vasopeptidasas incluyen otras 2 metaloproteinasas de zinc: la neprilisina (endopeptidasa neutra, NEP) y la enzima convertidora de endotelina, que también pueden ser objetivos de los efectos farmacológicos.
La neprilisina es una enzima producida por el endotelio vascular y está implicada en la degradación del péptido natriurético, así como de la bradicinina.
El sistema de péptidos natriuréticos está representado por tres isoformas diferentes: péptido natriurético auricular (tipo A), péptido natriurético cerebral (tipo B), que se sintetizan en la aurícula y el miocardio, y péptido C endotelial, que son inhibidores endógenos del RAAS en sus funciones biológicas y endotelina-1 (Tabla 1). Los efectos cardiovasculares y renales del péptido natriurético son reducir la presión arterial a través del efecto sobre el tono vascular y el equilibrio hídrico y electrolítico, así como los efectos antiproliferativos y antifibróticos sobre los órganos diana. Más recientemente, el sistema de péptidos natriuréticos está involucrado en la regulación metabólica de la oxidación de lípidos, la formación y diferenciación de adipocitos, la activación de adiponectina, la secreción de insulina y la tolerancia a los carbohidratos, lo que puede conferir protección contra el desarrollo del síndrome metabólico.
Hasta la fecha, se sabe que el desarrollo de enfermedades cardiovasculares está asociado con la desregulación del sistema de péptidos natriuréticos. Entonces, en la hipertensión, hay una deficiencia de péptido natriurético, lo que lleva a la sensibilidad a la sal y al deterioro de la natriuresis; en la insuficiencia cardíaca crónica (CHF), en el contexto de la deficiencia, se observa un funcionamiento anormal de las hormonas del sistema de péptidos natriuréticos.
Por lo tanto, los inhibidores de la NEP se pueden utilizar para potenciar el sistema de péptidos natriuréticos con el fin de lograr efectos hipotensores y protectores cardiorrenales adicionales. La inhibición de la neprilisina conduce a la potenciación de los efectos natriuréticos, diuréticos y vasodilatadores del péptido natriurético endógeno y, como resultado, a una disminución de la presión arterial. Sin embargo, la NEP también está involucrada en la degradación de otros péptidos vasoactivos, en particular ATI, ATII y endotelina-1. Por lo tanto, el equilibrio de los efectos sobre el tono vascular de los inhibidores de la NEP es variable y depende del predominio de los efectos constrictor y dilatador. Con el uso prolongado, el efecto antihipertensivo de los inhibidores de neprilisina se expresa débilmente debido a la activación compensatoria de la formación de ATII y endotelina-1.
En este sentido, la combinación de los efectos de los inhibidores de la ECA y los inhibidores de la NEP pueden potenciar significativamente los efectos hemodinámicos y antiproliferativos como resultado de un mecanismo de acción complementario, lo que llevó a la creación de fármacos con un mecanismo de acción dual, unidos bajo el nombre - inhibidores de la vasopeptidasa (Tabla 2, Fig. 1) .
Los inhibidores conocidos de vasopeptidasas se caracterizan por diversos grados de selectividad para NEP/ACE: omapatrilato - 8,9:0,5; fazidoprilato - 5.1:9.8; sampatrilat - 8.0:1.2. Como resultado, los inhibidores de la vasopeptidasa recibieron muchas más oportunidades para lograr un efecto hipotensor, independientemente de la actividad de la RAAS y el nivel de retención de sodio, y en la protección de órganos (regresión de la hipertrofia, albuminuria, rigidez vascular). El más estudiado en estudios clínicos fue el omapatrilato, que mostró una mayor eficacia antihipertensiva en comparación con los IECA, y en pacientes con ICC produjo un aumento de la fracción de eyección y mejores resultados clínicos (estudios IMPRESS, OVERTURE), pero sin ventajas sobre los IECA.
Sin embargo, en grandes ensayos clínicos con el uso de omapatrilat, se encontró una mayor incidencia de angioedema en comparación con los inhibidores de la ECA. Se sabe que la incidencia de angioedema cuando se usan inhibidores de la ECA es de 0,1 a 0,5% en la población, de los cuales el 20% de los casos son potencialmente mortales, lo que se asocia con un aumento múltiple en las concentraciones de bradiquinina y sus metabolitos. Los resultados de un gran estudio multicéntrico OCTAVE (n=25.302), que se diseñó específicamente para estudiar la incidencia de angioedema, mostraron que la incidencia de este efecto secundario durante el tratamiento con omapatrilato supera la del grupo de enalapril: 2,17 % frente a 0,68 %. (riesgo relativo 3.4). Esto se explica por el aumento del efecto sobre el nivel de cininas durante la inhibición sinérgica de ACE y NEP, asociado con la inhibición de la aminopeptidasa P, que está involucrada en la degradación de la bradicinina.
Un nuevo inhibidor dual de la vasopeptidasa bloqueador de ACE/NEP, el ilepatril, tiene una mayor afinidad por la ACE que la NEP. Al estudiar los efectos farmacodinámicos de ilepatril sobre el efecto sobre la actividad del RAAS y el péptido natriurético en voluntarios sanos, se encontró que el fármaco de forma dependiente de la dosis (a dosis de 5 y 25 mg) y significativamente (más del 88%) suprime ACE en plasma durante más de 48 horas, independientemente de la sensibilidad a la sal. Al mismo tiempo, el fármaco aumentó significativamente la actividad de la renina plasmática durante 48 horas y redujo el nivel de aldosterona. Estos resultados mostraron una supresión pronunciada y más prolongada de la SRAA, en contraste con el inhibidor de la ECA ramipril a una dosis de 10 mg, que se explica por un efecto tisular más significativo del ilepatril sobre la ECA y una mayor afinidad por la ECA, y un grado comparable de bloqueo de la RAAS en comparación con la combinación de irbesartán 150 mg + 10 mg de ramipril. En contraste con el efecto sobre el RAAS, el efecto de ilepatril sobre el péptido natriurético se manifestó por un aumento transitorio en el nivel de su excreción en el período de 4 a 8 horas después de una dosis de 25 mg, lo que indica una afinidad más baja y más débil. para NEP y lo distingue de omapatrilat. Además, en términos del nivel de excreción de electrolitos, el fármaco no tiene un efecto natriurético adicional en comparación con el ramipril o el irbesartán, así como con otros inhibidores de la vasopeptidasa. El efecto hipotensor máximo se desarrolla de 6 a 12 horas después de tomar el medicamento, y la disminución de la presión arterial media es de 5±5 y 10±4 mm Hg. a baja y alta sensibilidad a la sal, respectivamente. De acuerdo con las características farmacocinéticas, ilepatril es un profármaco con un metabolito activo, que se forma rápidamente con una concentración máxima en 1-1,5 horas y se elimina lentamente. Los ensayos clínicos de fase III están actualmente en marcha.
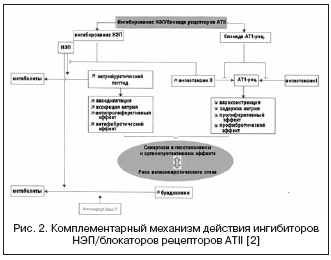
Una ruta alternativa a la supresión dual de RAAS y NEP está representada por una combinación de bloqueo de los receptores ATII y NEP (Fig. 2). Los bloqueadores de los receptores ATII no afectan el metabolismo de las cininas, a diferencia de los inhibidores de la ECA, por lo que tienen un riesgo potencial menor de desarrollar angioedema. Actualmente, el primer fármaco, un bloqueador de los receptores ATII con efecto inhibidor de la NEP en una proporción de 1:1, LCZ696, se encuentra en ensayos clínicos de fase III. La molécula de fármaco combinado contiene valsartán y un inhibidor de NEP (AHU377) en forma de profármaco. En un amplio estudio en pacientes con hipertensión (n=1328), LCZ696 a dosis de 200-400 mg mostró una ventaja en el efecto hipotensor sobre valsartán a dosis de 160-320 mg en forma de una disminución adicional de la presión arterial de 5 /3 y 6/3 mmHg. . . El efecto hipotensor de LCZ696 se acompañó de una disminución más pronunciada de la presión del pulso: de 2,25 y 3,32 mm Hg. a dosis de 200 y 400 mg, respectivamente, lo que actualmente se considera un factor pronóstico positivo por el efecto sobre la rigidez de la pared vascular y los resultados cardiovasculares. Al mismo tiempo, el estudio de biomarcadores neurohumorales durante el tratamiento con LCZ696 mostró un aumento en el nivel de péptido natriurético con un grado comparable de aumento en el nivel de renina y aldosterona en comparación con valsartán. La tolerabilidad en pacientes con hipertensión fue buena y no se observaron casos de angioedema. El ensayo PARAMOUMT ahora se ha completado en 685 pacientes con ICC y FE intacta. Los resultados del estudio mostraron que LCZ696 reduce el nivel de NT-proBNP de forma más rápida y pronunciada (el criterio principal de valoración es un marcador de aumento de la actividad del péptido natriurético y mal pronóstico en la ICC) en comparación con valsartán, y también reduce el tamaño de la aurícula izquierda. , lo que indica una regresión de su remodelación . Está en curso un estudio en pacientes con ICC y FE reducida (el estudio PARADIGM-HF).
Inhibidores del sistema de endotelina
El sistema de endotelina juega un papel importante en la regulación del tono vascular y el flujo sanguíneo regional. Entre las tres isoformas conocidas, la endotelina-1 es la más activa. Además de los conocidos efectos vasoconstrictores, la endotelina estimula la proliferación y síntesis de la matriz intercelular, y también, por efecto directo sobre el tono de los vasos renales, interviene en la regulación de la homeostasis hídrica y electrolítica. Los efectos de la endotelina se realizan a través de la interacción con receptores específicos de tipo A y tipo B, cuyas funciones son mutuamente opuestas: la vasoconstricción ocurre a través de los receptores de tipo A y la vasodilatación ocurre a través del tipo B. En los últimos años, se ha establecido que los receptores de tipo B juegan un papel importante en el aclaramiento de la endotelina-1, es decir, el bloqueo de estos receptores interrumpe la eliminación de endotelina-1 dependiente del receptor y aumenta su concentración. Además, los receptores de tipo B están involucrados en la regulación de los efectos renales de la endotelina-1 y el mantenimiento de la homeostasis de agua y electrolitos, lo cual es importante.
Actualmente, se ha demostrado el papel de la endotelina en el desarrollo de una serie de enfermedades, incl. AH, CHF, hipertensión pulmonar, enfermedad renal crónica; muestra una estrecha relación entre el nivel de endotelina y el síndrome metabólico, la disfunción endotelial y la aterogénesis. Desde la década de 1990 se está realizando una búsqueda de antagonistas de los receptores de endotelina adecuados para uso clínico; Ya se conocen 10 fármacos (“sentans”) con diversos grados de selectividad por los receptores de tipo A/B. El primer antagonista no selectivo de los receptores de la endotelina, bosentan, en un estudio clínico en pacientes con hipertensión mostró una eficacia hipotensora comparable a la del inhibidor de la ECA enalapril. Estudios posteriores sobre la eficacia de los antagonistas de la endotelina en la hipertensión han demostrado su relevancia clínica en el tratamiento de la hipertensión resistente y con alto riesgo cardiovascular. Estos datos se obtuvieron en dos grandes ensayos clínicos DORADO (n=379) y DORADO-AC (n=849), en los que se añadió darusentan a la terapia de combinación triple en pacientes con hipertensión resistente. En el estudio DORADO, los pacientes con hipertensión resistente se asociaron con enfermedad renal crónica y proteinuria, y como resultado de la adición de darusentan, se observó no solo una disminución significativa de la presión arterial, sino también una disminución de la excreción de proteínas. El efecto antiproteinúrico de los antagonistas de los receptores de la endotelina se confirmó posteriormente en un estudio en pacientes con nefropatía diabética utilizando avocentan. Sin embargo, en el estudio DORADO-AC, no hubo ninguna ventaja en la reducción adicional de la PA sobre los comparadores y el placebo, lo que motivó la finalización de los estudios posteriores. Además, en 4 grandes estudios de antagonistas de la endotelina (bosentan, darusentan, enrasentan) en pacientes con ICC se obtuvieron resultados contradictorios, lo que se explica por un aumento en la concentración de endotelina-1. El estudio adicional de los antagonistas de los receptores de la endotelina se suspendió debido a los efectos adversos asociados con la retención de líquidos (edema periférico, sobrecarga de volumen). El desarrollo de estos efectos está asociado al efecto de los antagonistas de la endotelina sobre los receptores tipo B, lo que ha cambiado la búsqueda de fármacos que afecten al sistema de endotelina por otras vías; y los antagonistas de los receptores de endotelina actualmente tienen una sola indicación, el tratamiento de la hipertensión pulmonar.
Teniendo en cuenta la alta importancia del sistema de endotelina en la regulación del tono vascular, se busca otro mecanismo de acción a través de la vasopeptidasa - EPF, que interviene en la formación de endotelina-1 activa (fig. 3) . El bloqueo de la ECA y la combinación con la inhibición de la NEP pueden suprimir eficazmente la formación de endotelina-1 y potenciar los efectos del péptido natriurético. Las ventajas de un mecanismo de acción dual son, por un lado, prevenir las desventajas de los inhibidores de la NEP asociadas con una posible vasoconstricción mediada por la activación de la endotelina, por otro lado, la actividad natriurética de los inhibidores de la NEP permite compensar la retención de líquidos. asociado con el bloqueo no selectivo de los receptores de endotelina. Daglutril es un inhibidor dual de NEP y EPF, que se encuentra en ensayos clínicos de fase II. Los estudios han demostrado efectos cardioprotectores pronunciados del fármaco debido a una disminución en la remodelación vascular y cardíaca, regresión de la hipertrofia y fibrosis.
Inhibidores directos de renina
Se sabe que los inhibidores de la ECA y los bloqueadores de los receptores ATII aumentan la actividad de la renina mediante un mecanismo de retroalimentación, que es la razón por la que se pierde la eficacia de los bloqueadores del SRAA. Renin representa el primer paso en la cascada RAAS; es producido por las células yuxtaglomerulares de los riñones. La renina a través del angiotensinógeno promueve la formación de ATII, la vasoconstricción y la secreción de aldosterona, y también regula los mecanismos de retroalimentación. Por lo tanto, la inhibición de la renina permite lograr un bloqueo más completo del sistema RAAS. La búsqueda de inhibidores de la renina ha estado ocurriendo desde la década de 1970; Durante mucho tiempo, no fue posible obtener una forma oral de inhibidores de la renina debido a su baja biodisponibilidad en el tracto gastrointestinal (menos del 2%). El primer inhibidor directo de renina apto para administración oral, aliskiren, se registró en 2007. Aliskiren tiene una biodisponibilidad baja (2,6%), una vida media larga (24-40 horas), una vía de eliminación extrarrenal. La farmacodinamia de aliskiren está asociada con una disminución del 80% en el nivel de ATII. En estudios clínicos en pacientes con hipertensión, aliskireno a dosis de 150-300 mg/día provocó una disminución de la PAS de 8,7-13 y 14,1-15,8 mm Hg. respectivamente, y DBP - por 7.8-10.3 y 10.3-12.3 mm Hg. . El efecto hipotensor de aliskiren se observó en diferentes subgrupos de pacientes, incluidos pacientes con síndrome metabólico, obesidad; en cuanto a la gravedad, fue comparable al efecto de los inhibidores de la ECA, los bloqueadores de los receptores ATII y se observó un efecto aditivo en combinación con valsartán, hidroclorotiazida y amlodipina. Varios estudios clínicos han demostrado efectos organoprotectores del fármaco: efecto antiproteinúrico en pacientes con nefropatía diabética (estudio AVOID, n=599), regresión de la hipertrofia ventricular izquierda en pacientes con hipertensión (estudio ALLAY, n=465) . Así, en el estudio AVOID, tras 3 meses de tratamiento con losartán a dosis de 100 mg/día y alcanzando el nivel objetivo de presión arterial (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Además, se están realizando una serie de estudios clínicos de aliskiren en el tratamiento de otras enfermedades cardiovasculares con una evaluación del impacto en el pronóstico de los pacientes: ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n =7000) estudios en pacientes con ICC, el estudio ALTITUDE en pacientes con diabetes mellitus y alto riesgo cardiovascular, el estudio ASPIRE en pacientes con remodelado postinfarto.
Conclusión
Para solucionar los problemas de prevención de las enfermedades cardiovasculares, continúa la creación de nuevos fármacos con un complejo mecanismo de acción múltiple, que permite un bloqueo más completo del RAAS a través de una cascada de mecanismos de regulación hemodinámica y neurohumoral. Los efectos potenciales de tales fármacos permiten no solo proporcionar un efecto antihipertensivo adicional, sino también lograr el control de los niveles de presión arterial en pacientes de alto riesgo, incluida la hipertensión resistente. Los medicamentos con un mecanismo de acción múltiple muestran ventajas en un efecto organoprotector más pronunciado, lo que evitará un mayor daño al sistema cardiovascular. Estudiar los beneficios de los nuevos fármacos que bloquean el RAAS requiere más investigación y evaluación de su impacto en el pronóstico de los pacientes con hipertensión y otras enfermedades cardiovasculares.



Literatura
1 Campbell DJ Inhibición de la vasopeptidasa: ¿un arma de doble filo? // Hipertensión. 2003 vol. 41. págs. 383-389.
2. Laurent S., Schlaich M., Esler M. Nuevos fármacos, procedimientos y dispositivos para la hipertensión // Lancet. 2012. vol. 380. Pág. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Inhibidores de la vasopeptidasa: ¿un nuevo concepto terapéutico en la enfermedad cardiovascular? // Circulación. 2001 vol. 104. Pág. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Inhibición de la endopeptidasa neutra y el sistema de péptidos natriuréticos: una estrategia en evolución en la terapéutica cardiovascular // Eur. Corazón J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Comparación del inhibidor de vasopeptidasa, omapatrilat y lisinopril sobre la tolerancia al ejercicio y la morbilidad en pacientes con insuficiencia cardíaca: ensayo aleatorizado IMPRESS // Lancet. 2000 vol. 356. Pág. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. Comparación de omapatrilat y enalapril en pacientes con insuficiencia cardíaca crónica: El ensayo aleatorizado de utilidad en la reducción de eventos de omapatrilat versus enalapril (OVERTURE) // Circulation. 2002 vol. 106. Pág. 920-926.
7. Warner K. K., Visconti J. A., Tschampel M. M. Bloqueadores de los receptores de angiotensina II en pacientes con angioedema inducido por inhibidores de la ECA // Ann. Farmacéutico. 2000 vol. 34. págs. 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat y enalapril en pacientes con hipertensión: el ensayo Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) // Am. J. Hipertensos. 2004 vol. 17. Pág. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Farmacocinética y farmacodinámica del inhibidor de vasopeptidasa AVE7688 en humanos // Clin. Farmacol. El r. 2006 vol. 79. Pág. 49-61.
10. Gu J., Noe A., Chandra P. et al. Farmacocinética y farmacodinámica de LCZ696, un nuevo inhibidor de neprilisina del receptor de angiotensina de doble acción (ARNi) // J. Clin. Farmacol. 2010 vol. 50. Pág. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Reducción de la presión arterial con LCZ696, un nuevo inhibidor de acción dual del receptor de angiotensina II y la neprilisina: un estudio comparativo activo, aleatorizado, doble ciego, controlado con placebo // Lancet. 2010 vol. 375. Pág. 1255-1266.
12. Solomon SD, Zile M., Pieske B. et al. El inhibidor de neprilisina del receptor de angiotensina LCZ696 en insuficiencia cardíaca con fracción de eyección conservada: un ensayo controlado aleatorio doble ciego de fase 2 // Lancet. 2012. vol. 380 (9851). pág. 1387-1395.
13. Emergencias de Levin Endotelinas // N. Engl. J.Med. 1995 vol. 333. Pág. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Papel de la endotelina-1 en la hipertensión clínica: 20 años después // Hipertensión. 2008 vol. 52. Pág. 452-459.
15. Burnier M., Forni V. Antagonistas de los receptores de endotelina: ¿un lugar en el manejo de la hipertensión esencial? // Nefrol. Marcar. trasplante. 2011.0:1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. El efecto de un antagonista del receptor de endotelina, bosentan, sobre la presión arterial en pacientes con hipertensión esencial. Investigadores de hipertensión con bosentán // N. Engl. J.Med. 1998 vol. 338. Pág. 784-790.
17. Weber M.A., Black H., Bakris G. et al. Un antagonista selectivo del receptor de endotelina para reducir la presión arterial en pacientes con hipertensión resistente al tratamiento: un ensayo aleatorizado, doble ciego, controlado con placebo // Lancet. 2009 vol. 374. Pág. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Resultados divergentes utilizando presiones arteriales clínicas y ambulatorias: informe de un ensayo de hipertensión resistente a darusentan // Hipertensión. 2010 vol. 56. Pág. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan para la nefropatía diabética manifiesta // J. Am. soc. nefrol. 2010 vol. 21. Pág. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. La enzima convertidora de endotelina/inhibidor de endopeptidasa neutra SLV338 previene la remodelación cardíaca hipertensiva de manera independiente de la presión arterial // Hipertensión. 2011 vol. 57. Pág. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Supresión de la angiotensina II en humanos por el inhibidor de la renina teóricamente activo Aliskiren (SPP100): comparación con enalapril // Hipertensión. 2002 vol. 39(1). P. E1-8.
22. Alreja G., Joseph J. Renin y la enfermedad cardiovascular: ¿camino desgastado o nuevo rumbo? // Mundo J. Cardiol. 2011 vol. 3(3). págs. 72-83.
23. Ingelfinger J.R. Aliskiren y terapia dual en diabetes mellitus tipo 2 // N. Engl. J.Med. 2008 vol. 358(23). pág. 2503-2505.
24. Pouleur A.C., Uno H., Prescott M.F., Desai A. (para los investigadores de ALLAY). La supresión de la aldosterona media la regresión de la hipertrofia ventricular izquierda en pacientes con hipertensión // J. Renin-Angiotensin-Aldosterone System. 2011 vol. 12. págs. 483-490.
25. Kelly D. J., Zhang Y., Moe G. et al. Aliskiren, un nuevo inhibidor de la renina, es renoprotector en un modelo de nefropatía diabética avanzada en ratas // Diabetol. 2007 vol. 50. Pág. 2398-2404.
La historia del estudio del sistema renina-angiotensina-aldosterona (RAAS), que resultó ser el más exitoso en términos de desarrollar enfoques para la modulación farmacológica de su actividad, lo que permite prolongar la vida de pacientes con enfermedades cardiovasculares y renales. , comenzó hace 110 años. Cuando se identificó la renina - el primer componente. Posteriormente, en estudios experimentales y clínicos, fue posible aclarar el papel fisiológico de la renina y su importancia en la regulación de la actividad RAAS en diversas condiciones patológicas, lo que se convirtió en la base para el desarrollo de una estrategia terapéutica altamente efectiva: los inhibidores directos de la renina.
Actualmente, el primer inhibidor directo de la renina, Rasilez (aliskiren), está justificado incluso en situaciones en las que otros bloqueadores del RAAS, los inhibidores de la ECA y los ARB, no están indicados o su uso es difícil debido al desarrollo de eventos adversos.
Otra circunstancia que permite contar con las posibilidades adicionales de los inhibidores directos de la renina en la protección de los órganos diana de la hipertensión frente a otros bloqueadores del SRAA es que al utilizar fármacos que bloquean el SRAA a otros niveles, según la ley de la retroalimentación negativa, no es un aumento en la concentración de prorrenina y un aumento en la actividad de la renina plasmática. Es esta circunstancia la que cancela la disminución a menudo observada en la efectividad de los inhibidores de la ECA, incluso desde el punto de vista de su capacidad para reducir la presión arterial elevada. A principios de la década de 1990, cuando muchos de los efectos organoprotectores de los inhibidores de la ECA no se establecieron de manera tan confiable como en la actualidad, se demostró que a medida que aumenta la dosis, la actividad de la renina plasmática y la concentración de angiotensina plasmática aumentan significativamente. Junto con los inhibidores de la ECA y los BRA, las tiazidas y los diuréticos de asa también pueden provocar un aumento de la actividad de la renina plasmática.
Aliskiren fue el primer inhibidor directo de la renina, cuya eficacia se confirmó en ensayos clínicos controlados de fase III, que tiene una duración de acción suficiente y reduce la presión arterial elevada incluso en monoterapia, y su prescripción ahora puede considerarse como un enfoque innovador para el tratamiento de la hipertensión. Se hicieron comparaciones de su efecto sobre la concentración plasmática y la actividad de los componentes individuales del RAAS con los inhibidores de la ECA y los ARB. Resultó que aliskiren y enalapril reducen casi por igual la concentración plasmática de angiotensina II, pero a diferencia de aliskiren, la administración de enalapril provocó un aumento de más de 15 veces en la actividad de la renina plasmática. La capacidad de aliskiren para prevenir cambios negativos en el equilibrio de actividad de los componentes de RAAS también se demostró en comparación con los ARB.
Un análisis combinado de un estudio clínico que incluyó un total de 8481 pacientes que recibieron monoterapia con aliskiren o placebo mostró que una dosis única de aliskiren a una dosis de 150 mg/día. o 300 mg/día. provocó una disminución de la PAS de 12,5 y 15,2 mm Hg. respectivamente, en comparación con una reducción de 5,9 mmHg, placebo (R<0,0001). Диастолическое АД снижалось на 10,1 и 11,8 мм рт.ст. соответственно (в группе, принимавшей плацебо – на 6,2 мм рт.ст.; Р < 0,0001). Различий в антигипертензивном эффекте алискирена у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено.
En 2009 se publicaron los resultados de un ensayo clínico controlado multicéntrico, en el que se comparó la eficacia de aliskireno e hidroclorotiazida en 1124 pacientes hipertensos. Si era necesario, se añadía amlodipino a estos fármacos. Al final del período de monoterapia, se hizo evidente que aliskireno conduce a una disminución más pronunciada de la presión arterial que la hidroclorotiazida (-17,4/-12,2 mm Hg frente a -14,7/-10,3 mm Hg; R< 0,001)
Inhibidor directo de renina (aliskiren)
Estimula la secreción de renina por los riñones, reduciendo el volumen de sangre circulante y la perfusión del riñón. La renina, a su vez, convierte el angiotensinógeno en angiotensina I, un precursor de la angiotensina II, y esta última desencadena una cascada de reacciones que conducen a un aumento de la presión arterial. Por tanto, la supresión de la secreción de renina puede reducir la producción de angiotensina II. Al tomar diuréticos tiazídicos, inhibidores de la ECA y ARB, aumenta la actividad de la renina plasmática. Por lo tanto, la supresión de la actividad de la renina puede ser una estrategia potencialmente eficaz para suprimir todo el sistema renina-angiotensina. Aliskiren es el primer fármaco de una nueva clase: un inhibidor directo de la renina, para el que se ha demostrado actividad hipotensora. La biodisponibilidad mejorada de la formulación oral de aliskireno en comparación con los fármacos de este tipo ofrecidos anteriormente y la vida media prolongada permiten que este fármaco se tome una vez al día.
Aliskiren reduce eficazmente la presión arterial tanto en monoterapia como en combinación con diuréticos tiazídicos (hidroclorotiazida), inhibidores de la ECA (ramipril, lisinopril). ARB (valsartán) o BCC (amlodipino). Cuando se toma aliskiren con estos agentes antihipertensivos, la actividad de la renina plasmática no aumenta, sino que permanece en el nivel basal o incluso por debajo de él. Alixiren tiene seguridad y tolerabilidad similares a las de un placebo y no interactúa con una amplia gama de medicamentos, con la excepción de la furosemida. Actualmente hay datos limitados sobre la eficacia a largo plazo y la tolerabilidad de aliskiren en pacientes diabéticos con hipertensión. Como resultado, el papel exacto de este fármaco en el tratamiento de la hipertensión en pacientes diabéticos no se ha establecido por completo.
ALISKIREN (medicamento Rasilez): tabletas de 150 mg y 300 mg, dosis inicial de 150 mg / 1 vez por día, con control insuficiente de la presión arterial después de 2 semanas, la dosis se puede aumentar a 300 mg / 1 vez por día
Mecanismo de acción. Agente antihipertensivo, inhibidor selectivo de renina de estructura no peptídica. Cuando se usa aliskiren como monoterapia y en combinación con otros agentes antihipertensivos, se neutraliza la supresión de la retroalimentación negativa, lo que resulta en una disminución de la actividad de la renina plasmática (en pacientes con hipertensión arterial en un promedio de 50-80 %), así como de los niveles de antitensina I y II. Después de la primera dosis, no hay reacción hipotensora (el efecto de la primera dosis) y un aumento reflejo de la frecuencia cardíaca en respuesta a la vasodilatación.
Farmacocinética. Después de la administración oral, el tiempo para alcanzar la concentración plasmática máxima de aliskireno es de 1 a 3 horas, la biodisponibilidad absoluta es del 2,6 %. La ingesta simultánea de alimentos no tiene un efecto significativo sobre la farmacodinámica del fármaco. Por lo tanto, aliskiren se puede tomar con o sin alimentos. Aliskiren se une moderadamente a las proteínas plasmáticas (47-51%), independientemente de la concentración. La vida media de eliminación de aliskiren es de 40 horas (varía de 34 a 41 horas). Se excreta principalmente sin cambios a través de los intestinos (91%). Aproximadamente el 1,4% de la dosis ingerida se metaboliza con la participación de la isoenzima CYP3A4. Después de la administración oral, alrededor del 0,6 % del aliskiren se excreta por vía renal. Cuando se usa aliskiren en pacientes mayores de 65 años, no se requiere ajuste de dosis del medicamento. La farmacocinética de aliskiren no cambia significativamente en pacientes con insuficiencia hepática de leve a moderada (puntuación de Child-Pugh de 5 a 9).
la interacción de drogas. La probabilidad de interacción de aliskiren con otros medicamentos es baja. Cuando se usa aliskiren con uno de los siguientes medicamentos, su Cmax o AUC puede cambiar: valsartán (disminución de 28%), metformina (disminución de 28%), amlodipina (aumento de 29%), cimetidina (aumento del 19%). Dado que en estudios experimentales se encontró que la glicoproteína P (un transportador de moléculas de membrana) juega un papel importante en la regulación de la absorción y distribución de aliskiren, es posible cambiar la farmacocinética de este último cuando se usa simultáneamente con sustancias que inhiben P -glucoproteína (dependiendo del grado de inhibición). No hubo una interacción significativa de aliskiren con inhibidores débil o moderadamente activos de la glicoproteína P, como atenolol, digoxina, amlodipino y cimetidina. Con el uso simultáneo con un inhibidor activo de la atorvastatina de la glicoproteína P (a una dosis de 80 mg / día) en un estado de equilibrio, se observa un aumento en el AUC y C max de aliskiren (dosis de 300 mg / día) en un 50%. Con la administración simultánea de un inhibidor activo de la glicoproteína P, ketoconazol (200 mg) y aliskiren (300 mg), se observa un aumento de la Cmax de este último en un 80 %. En estudios experimentales, la administración simultánea de aliskiren con ketoconazol provocó un aumento de la absorción de este último en el tracto gastrointestinal y una disminución de su excreción con la bilis. Se esperan cambios en la concentración plasmática de aliskiren en plasma cuando se usa simultáneamente con ketoconazol o atorvastatina en el rango de concentraciones determinado al aumentar la dosis de aliskiren en 2 veces. En ensayos clínicos controlados se ha demostrado la seguridad de aliskireno a dosis de 600 mg y un aumento de 2 veces de la dosis terapéutica máxima recomendada. Cuando se utiliza aliskireno junto con ketoconazol o atorvastatina, no es necesario ajustar la dosis de aliskireno. Cuando se usó con un inhibidor de la glicoproteína P tan activo como la ciclosporina (200 y 600 mg), las personas sanas mostraron un aumento en la Cmax y el AUC de aliskiren (75 mg) de 2,5 y 5 veces, respectivamente (no se recomienda usar aliskiren simultáneamente con ciclosporina). Con el uso simultáneo de aliskiren con furosemida, se produce una disminución del AUC y la Cmax de furosemida en un 28 % y un 49 %, respectivamente. Para prevenir una posible retención de líquidos al prescribir aliskireno junto con furosemida al inicio y durante el tratamiento, es necesario ajustar la dosis de furosemida en función del efecto clínico. Se debe tener precaución cuando se utiliza aliskiren de forma concomitante con sales de potasio, diuréticos ahorradores de potasio, sustitutos de la sal de mesa que contienen potasio o cualquier otro medicamento que pueda aumentar la concentración de potasio en la sangre.
Efecto secundario. Del sistema digestivo: a menudo - diarrea. Reacciones dermatológicas: a veces - erupción cutánea Del lado de los parámetros de laboratorio: raramente - una ligera disminución en la concentración de hemoglobina y hematocrito (en promedio de 0,05 mmol / l y 0,16%, respectivamente), que no requirió la interrupción del tratamiento, un ligero aumento en la concentración de potasio en el suero sanguíneo (0,9% en comparación con el 0,6% con placebo). Reacciones alérgicas: en algunos casos - angioedema.
Contraindicaciones y restricciones. Contraindicaciones: niños y adolescentes menores de 18 años, embarazo, lactancia (amamantamiento), hipersensibilidad a aliskiren. El uso durante el embarazo y la lactancia (amamantamiento) está contraindicado.
No se ha establecido la eficacia y seguridad de aliskireno en pacientes con insuficiencia hepática grave (más de 9 puntos en la escala de Child-Pugh).
No se ha establecido la eficacia y seguridad de aliskiren: en pacientes con insuficiencia renal grave (creatinina sérica >150 µmol/l para mujeres y >177 µmol/l para hombres y/o tasa de filtración glomerular inferior a 30 ml/min), con síndrome nefrótico, hipertensión renovascular y durante un procedimiento regular de hemodiálisis.
Con precaución, el alisikiren debe usarse en pacientes con estenosis de la arteria renal unilateral o bilateral o estenosis de la arteria de un solo riñón, diabetes mellitus, BCC reducido, hiponatremia, hiperpotasemia o pacientes después de un trasplante de riñón.
No se ha establecido la eficacia y seguridad de aliskiren: en pacientes con insuficiencia renal grave (creatinina sérica >150 µmol/l para mujeres y >177 µmol/l para hombres y/o tasa de filtración glomerular inferior a 30 ml/min), con síndrome nefrótico, hipertensión renovascular y durante un procedimiento regular de hemodiálisis, así como en pacientes con disfunción hepática severa (más de 9 puntos en la escala de Child-Pugh), en pacientes con estenosis unilateral o bilateral de las arterias renales o estenosis del arteria de un solo riñón.
En pacientes con diabetes durante la terapia con aliskiren en combinación con un inhibidor de la ECA, hubo un aumento en la frecuencia de hiperpotasemia (5,5%). Cuando se usa aliskiren y otros medicamentos que afectan el RAAS en pacientes con diabetes, es necesario controlar regularmente la composición de electrolitos del plasma sanguíneo y la función renal.
En el contexto de la terapia con aliskiren, es posible un aumento en la concentración de potasio, creatinina y nitrógeno ureico en sangre, que es característico de los medicamentos que afectan el RAAS. Al comienzo del tratamiento con aliskiren en pacientes con BCC reducido y / o hiponatremia (incluso en el contexto de altas dosis de diuréticos), es posible la hipotensión arterial sintomática. Antes del uso, se debe realizar la corrección de las violaciones del equilibrio agua-sal. En pacientes con BCC reducido y/o hiponatremia, el tratamiento debe realizarse bajo estrecha supervisión médica.
El sistema renina-angiotensina-aldosterona juega un papel clave en la regulación de la presión arterial y el equilibrio de líquidos y electrolitos. Un inhibidor directo de la renina: aliskiren, al reducir la actividad de la renina plasmática, tiene efectos cardioprotectores y nefroprotectores. El efecto antihipertensivo no depende del género, raza, edad, índice de masa corporal. El efecto antihipertensivo de aliskiren y los inhibidores de la enzima convertidora de angiotensina, los bloqueadores de los receptores de angiotensina II y los antagonistas del calcio es comparable. Aliskiren es eficaz en pacientes con obesidad, diabetes mellitus, insuficiencia renal y síndrome metabólico.
Inhibidores directos de renina - aliskireno en el tratamiento de la hipertensión arterial
El sistema renina-angiotensina-aldosterona juega un papel clave en la regulación de la presión arterial y el equilibrio de líquidos y electrolitos. Inhibidor directo de la renina: aliskireno, que disminuye la actividad de la renina plasmática y proporciona efectos cardioprotectores y nefroprotectores. El efecto antihipertensivo es independiente del género, raza, edad, índice de masa corporal. El efecto antihipertensivo de aliskiren y los inhibidores de la enzima convertidora de angiotensina, bloqueadores de los receptores de angiotensina II, antagonistas del calcio es comparable. Aliskiren es efectivo en pacientes con obesidad, diabetes, disfunción renal y síndrome metabólico.
En el curso del estudio del sistema renina-angiotensina-aldosterona (RAAS), se han desarrollado enfoques para regular su actividad farmacológica. El primer componente del RAAS, la renina, se identificó hace 110 años. Posteriormente se demostró su importancia en la regulación de la actividad del RAAS en condiciones patológicas, lo que se convirtió en la base para el desarrollo de los inhibidores directos de la renina (DRI). El RAAS juega un papel clave en la regulación de la presión arterial (PA) y el equilibrio de líquidos y electrolitos. Un aumento en la actividad de RAAS juega un papel importante en la formación y progresión de la hipertensión arterial (HA), la insuficiencia cardíaca crónica (CHF), la enfermedad renal crónica y la aterosclerosis sistémica. RAAS está directamente involucrado en los procesos de crecimiento y diferenciación de tejidos, modulación de la inflamación y apoptosis, así como la potenciación de la síntesis y secreción de una serie de sustancias neurohumorales. Los principales efectos de RAAS se realizan a través de la angiotensina II (ATII) a través de la estimulación de receptores específicos. La activación del subtipo 1 del receptor de angiotensina (AT1) conduce a la vasoconstricción, estimula la liberación de vasopresina, aldosterona, endotelina, norepinefrina. Se sigue estudiando el papel fisiológico de otros subtipos de receptores de angiotensina (AT3, AT4 y ATx). ATII contribuye a la acumulación de matriz de colágeno, producción de citocinas, moléculas adhesivas, activación del sistema de señalización intracelular, aumento de la expresión de genes de fenotipo fetal, juega un papel importante en la remodelación miocárdica y la hipertrofia del ventrículo izquierdo (VI), ATII participa en los procesos de remodelación arterial, intensificación del estrés oxidativo y apoptosis, contribuye a la formación y progresión de hipertensión, ICC, daño vascular aterosclerótico, nefropatía diabética y no diabética, angiopatía en diabetes mellitus (DM), eclampsia de mujeres embarazadas, enfermedad de Alzheimer. La progresión de las enfermedades cardiovasculares no depende del efecto vasopresor de la ATII.
La secreción de renina es el primer paso para aumentar la síntesis de ATI, ATII y otros productos de la cascada RAAS. La ejecución de los efectos posteriores de SRAA está modulada por la influencia de la renina sobre receptores específicos, induciendo un aumento de ATII.
Hasta hace poco, existían los siguientes inhibidores de RAAS: inhibidores de la enzima convertidora de angiotensina (inhibidores de la ECA) y bloqueadores de los receptores ATII (ARB). El mecanismo de acción de los inhibidores de la ECA es el siguiente: se suprime la actividad de la ECA, lo que provoca una disminución de los efectos de la ATII y una ralentización de la degradación de los vasopresores (bradicinina y prostaglandina E 2). Los ARB inhiben competitivamente los receptores ATII y reducen los efectos de ATII. Los receptores de renina y prorrenina se encuentran en la superficie celular. La activación de la vía de señalización celular por parte de la renina provoca fibrosis e hipertrofia celular. En los últimos años se ha controlado la actividad del RAAS mediante la limitación de la producción de ATII, bloqueo de ATII y de los receptores de aldosterona, debido a la restricción de la secreción de renina, principalmente mediante el uso de β-bloqueantes. Numerosos estudios han demostrado que una disminución adecuada de la actividad del RAAS con la ayuda de inhibidores de la ECA, ARB o aldosterona se postula en lugar de lograrse, ya que el fenómeno de "escape" de los efectos antihipertensivos y organoprotectores de los bloqueadores del RAAS se desarrolla durante su largo plazo. usar. Para superar este fenómeno, se utilizan combinaciones de inhibidor de la ECA + BRA, inhibidor de la ECA + bloqueador β, inhibidor de la ECA + espironolactona. La aparición de PIR se ve como una forma de lograr un control más completo de la actividad RAAS y superar el fenómeno de "escape".
Los primeros PIR se sintetizaron en la década de 1970, pero el primer fármaco apto para administración oral fue el aliskiren (A). A., al unirse a la parte activa de la molécula diana, evita su interacción con el angiotensinógeno. Al reducir la actividad de la renina plasmática (ARP), A. tiene efectos cardioprotectores y nefroprotectores. Los inhibidores de RAAS estimulan ARP, lo que resulta en los siguientes efectos: vasoconstricción en los glomérulos, inflamación, fibrosis (riñones); hipertrofia, fibrosis, vasoconstricción (corazón); hiperplasia, hipertrofia, inflamación, oxidación de lípidos, fibrosis (vasos); vasoconstricción (cerebro). A. actúa en el punto de activación del RAAS y reduce el ARP. A diferencia de los inhibidores de la ECA y los ARB, A reduce los niveles de ATI, AII y ARP. La renina tiene actividad tanto enzimática como mediada por receptores.
Farmacocinética A. Los estudios clínicos han demostrado una tolerabilidad comparable al placebo. La duración de la acción de este fármaco supera las 24 horas y la vasodilatación renal puede persistir hasta 48 horas. La vida media de A es de aproximadamente 40 horas, lo que proporciona una dosis única por día. La dosis inicial recomendada A es de 150 mg con un aumento adicional a 300 mg. Las características farmacocinéticas de A no dependen de la glucemia en ayunas ni de las concentraciones plasmáticas de hemoglobina glicosilada. La eliminación del fármaco se lleva a cabo sin cambios en la bilis, la excreción en la orina es<1%. Исследования первой и второй фазы показали, что препарат способствует эффективной блокаде РААС и дозозависимому предотвращению повышения уровня АД . Полный антигипертензивный эффект наступает через 2 недели и не зависит от пола, расы, возраста, индекса массы тела. А обладает минимальным риском лекарственных взаимодействий, не требует коррекции дозы при хронической почечной недостаточности (ХПН), при поражении печени. Добавление А к ловастатину, атенололу, варфарину, фуросемиду, дигоксину, целекоксибу, гидрохлоротиазиду (ГХТЗ), рамиприлу, валсартану, метформину и амлодипину не приводило к клинически значимому увеличению экспозиции А. Совместное его применение с аторвастатином приводило к 50% увеличению Cmax (максимальная концентрацию препарата) и AUC (площадь под кривой «концентрация - время») после приема нескольких доз. Совместное применение 200 мг кетоконазола 2 раза в день с А приводило к 80% увеличению уровня А в плазме. При совместном применении А с фуросемидом AUC и Cmax фуросемида снижались на 30 и 50% соответственно . Не требуется коррекции дозы А у пациентов с ХПН. У пациентов с ХПН отмечается умеренное (~двухкратное) увеличение экспозиции А, но оно не коррелировало с тяжестью поражения почек и клиренсом креатинина. Клиренс А составлял 60–70 % у здоровых. Почечный клиренс А уменьшался с увеличением тяжести поражения почек. Поскольку поражение почек оказывает только умеренное влияние на экспозицию А, то коррекция дозы А, скорее всего, не требуется у пациентов с гипертензией и поражением почек. Не требуется коррекции дозы А и у пациентов поражением печени. Не было отмечено достоверной корреляции между экспозицией А и тяжестью поражения печени. А способен осуществлять блокаду РААС, что приводит к снижению сосудистого тонуса и системного АД. Однако препарат не лишен и негативных качеств, связанных с феноменом «ускользания», что характерно для всех лекарственных средств, блокирующих активность РААС. Снижение эффективности А вследствие восстановления секреции ренина или наличия синдрома отмены не подтверждается клиническими наблюдениями .
Eficacia antihipertensiva A. ARP es un indicador necesario no solo para el diagnóstico de formas secundarias raras de hipertensión (renovascular). La importancia clínica y pronóstica de ARP es la siguiente: el indicador aumenta con la hipertensión en combinación con otros factores de riesgo (sexo masculino, tabaquismo, diabetes tipo 2, obesidad (Ob.), síndrome metabólico) y en presencia de daño en órganos diana ( TOM) (disminución persistente de la tasa de filtración glomerular); un aumento de la renina ARP puede ser iatrogénico, provocado por inhibidores de la ECA y/o diuréticos (asa, tiazida), provocando pérdida renal de sodio: se observa una mayor activación del SRAA, lo que conduce a la pérdida del control de la presión arterial y a la progresión de la ICC; un aumento de ARP siempre predispone a la exacerbación de la MPO y complicaciones cardiovasculares (CV) y renales potencialmente fatales; el aumento de ARP es un factor independiente para el efecto farmacológico de PIR, lo que permite lograr una disminución de la presión arterial y la inhibición de la progresión de POM. A. puede reivindicar el papel de un fármaco antihipertensivo eficaz en monoterapia y en combinación con otros fármacos. Las indicaciones para el uso de PIR son: variantes de hipertensión con hiperrenina, hipertensión con normorenina, en las que la prorrenina y la activación mediada de los receptores de prorrenina conducen a la destrucción del tejido. La PIR está indicada no solo para la hipertensión renovascular y la ICC, sino también para el aumento de la concentración plasmática de prorrenina (hipertensión con hiperactivación del sistema nervioso simpático, síndrome metabólico, diabetes tipo 2, menopausia).
La monoterapia A. proporciona una reducción dependiente de la dosis en la presión arterial diastólica (PAD) y la presión arterial sistólica (PAS) en pacientes con hipertensión leve a moderada. La evaluación de la eficacia y seguridad de A. en 672 pacientes con hipertensión de grado I-II (st.) en un estudio controlado con placebo de 8 semanas reveló una disminución dependiente de la dosis en la PAS y la PAD. El efecto antihipertensivo de A persistió durante dos semanas después de su retirada; A fue bien tolerado; la frecuencia de eventos adversos no difirió del placebo. A - nombre comercial rasilez (P) - a una dosis de 150 mg reduce la PAS en 13 mm Hg. Art., y PAD por 10,3 mm Hg. Art., ya una dosis de 300 mg reduce la PAS de 15 a 22 mm Hg. Arte. (dependiendo del art. AG), y DBP - por 11 mm Hg. Arte. A proporciona control de la presión arterial en el período temprano en la mañana. Después de la cancelación de A, no hay fenómeno de "rebote". Análisis agrupado de ensayos clínicos que incluyen 8481 pacientes. tratados con monoterapia A o placebo, mostró que una dosis única de A a una dosis de 150 o 300 mg/día provocó una disminución de la PAS de 12,5 y 15,2 mm Hg. Arte. respectivamente, en comparación con una disminución de 5,9 mm Hg. Arte. en pacientes que recibieron placebo (p<0,0001). ДАД снижалось на 10,1 (на дозе 150 мг) и 11,8 мм рт. ст. (на дозе 300 мг) соответственно (в группе плацебо - на 6,2 мм рт. ст., р<0,0001). Различий в антигипертензивном эффекте А у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено. При применении иАПФ увеличиваются концентрации проренина и АРП (снижается эффективность иАПФ). При увеличении дозы иАПФ достоверно нарастает АРП и плазменная концентрация АТI . Исследование А в сравнении с иАПФ у пациентов с мягкой и умеренной АГ установило следующее: А достоверно больше снижает ДАД и САД, чем рамиприл через 12 недель лечения (монотерапия). А ± гидрохлортиазид (ГХТЗ) достоверно больше снижает ДАД и САД, чем рамиприл ± ГХТЗ через 26 недель лечения. А достоверно больше снижает ДАД и САД, чем рамиприл через 12 недель лечения (монотерапия) у пациентов с АГ II ст. Терапия А обеспечивает достоверно лучший контроль АД по сравнению с рамиприлом. САД и ДАД возвращаются к исходному уровню более быстро после отмены рамиприла, чем после отмены А. Сравнение гипотензивной эффективности А, ирбесартана и рамиприла после пропущенной дозы показало следующее: после пропущенной дозы достигнутое снижение АД было достоверно больше в группе А., чем в группе рамиприла . Достоверно больший процент снижения АД поддерживается после пропущенной дозы А по сравнению с ирбесартаном или рамиприлом. Возвращение к исходному АД происходит более плавно после отмены А., чем рамиприла. А. и эналаприл почти в равной степени уменьшают плазменную концентрацию АТП, но в отличие от А прием эналаприла приводил к более чем 15-кратному росту АРП. В условиях низкосолевой диеты индуцированная А органная (в частности, почечная) вазодилатация может сохраняться до 48 часов. Провоцировать подъем АРП могут препараты, стимулирующие натрийурез (тиазидовые и петлевые диуретики). Назначение А. в этой ситуации один из наиболее действенных подходов к устранению реактивного повышения АРП при комбинации с иАПФ и тиазидовым диуретиком.
En 2009 se publicaron los resultados de un ensayo clínico controlado multicéntrico, en el que se comparó la eficacia de A y HCTZ (terapia antihipertensiva inicial) en 1124 pacientes hipertensos; si era necesario, se añadía amlodipino a estos fármacos. Al final del período de monoterapia (semana 12), quedó claro que A conduce a una disminución más pronunciada de la presión arterial que HCTZ (-17,4/-12,2 mm Hg frente a -14,7/-10,3 mm Hg Hg, r<0,001). Эти результаты важны, поскольку большинство пациентов, страдающих АГ, исходно нуждаются в комбинированной антигипертензивной терапии. Оптимизация комбинированной антигипертензивной терапии важна у пациентов с Ож. при этом у А имеются дополнительные преимущества . Больные с Ож, у которых полная (25 мг/сут) доза ГХТЗ не приводила к снижению АД, были рандомизированы на группы, которым назначали амлодипин + ГХТЗ (10/25 мг/сут), ирбесартан + ГХТЗ (300/25 мг/сут) и А. + ГХТЗ (300/25 мг/сут). По мере нарастания ст. Ож антигипертензивная эффективность схем лечения (БРА + ГХТЗ, антагонист кальция + ГХТЗ) снижается. В группе с Ож. III ст. (ИМТ≥40 кг/м 2) только у 50% удалось достичь целевого АД с помощью ирбесартана + ГХТЗ, у 43,8% - с помощью амлодипина + ГХТЗ и лишь у 16,7% - с помощью ГХТЗ. При менее выраженном (I–II ст.) Ож более чем у 40% пациентов, получавших БРА + ГХТЗ или амлодипин + ГХТЗ, и более чем у 60% больных, принимавших только ГХТЗ, целевое АД не было достигнуто. В группе пациентов с Ож. I-II ст., получавших А. + ГХТЗ, целевого АД достигли 56,7% больных, а с Ож. III ст. - 68,8%. АГ, сочетающаяся с Ож, часто ассоциируется с увеличением активности РААС и трудно корригируется, поэтому в таких случаях может быть назначен А.
Se ha establecido la capacidad de A. para reducir la presión arterial y reducir la albuminuria. En el estudio AVOID en 599 pacientes con nefropatía diabética con hipertensión, se evaluó el efecto de la combinación de las dosis máximas de losartán y A sobre la albuminuria (mediante la relación albúmina/creatinina en orina). La adición de A (300 mg/día) a losartán (100 mg/día) se acompañó de una disminución significativa del cociente albúmina/creatinina en orina en un 20% en el conjunto del grupo (100%) y en un 24,7% en 50% o más. En el grupo de losartán + placebo, se logró una disminución del cociente albúmina/creatinina urinaria del 50 % o más en solo el 12,5 % de los pacientes (p<0,001). ПИР могут уменьшить альбуминурию как в режиме монотерапии, так и при комбинации с БРА, позволяющей достичь оптимальной ст. блокады РААС, обеспечивающей устранение генерализованной и локально-почечной дисфункции эндотелия.
Y con terapia combinada de hipertensión. En pacientes con hipertensión leve a moderada sin y con A. + HCTZ proporcionan una reducción significativa de la PAD y la PAS. Más pacientes logran el control de la PA con la combinación A + HCTZ que con otras combinaciones de HCTZ. En pacientes con hipertensión y DM, A+ ramipril reduce significativamente mejor la presión arterial que ambos componentes de la monoterapia. A proporciona un control de la presión arterial significativamente mejor que el ramipril. En pacientes con hipertensión de leve a moderada, A+ valsartan reduce la presión arterial significativamente mejor que ambos componentes de la monoterapia. A reduce significativamente la presión arterial cuando se combina con amlodipino a una dosis de 5 mg/día. A aumenta el nivel de control de la presión arterial en comparación con amlodipino a una dosis de 5 mg/día. R. ± HCTZ son efectivos en la terapia a largo plazo de la hipertensión. A + valsartán ± HCTZ proporciona eficacia antihipertensiva a largo plazo (análisis intermedio de 6 meses de terapia).
En 2009 se publicó el diseño del estudio ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardio-Renal Endpoints) (parte del programa ASPIRE HIGHER), que estudia el efecto del bloqueo dual del RAAS utilizando una combinación de A y estándar. (inhibidor de la ECA o ARB) en pacientes con diabetes tipo 2 con alto riesgo de CVC y complicaciones renales, en parte debido al aumento de la RDA. El objetivo principal de este estudio es evaluar la efectividad de agregar A a la terapia estándar sobre el efecto en el punto final combinado (muerte cardiovascular y complicaciones: reanimación exitosa, infarto de miocardio no fatal, accidente cerebrovascular no fatal, hospitalización no planificada debido a insuficiencia cardíaca congestiva; desarrollo de insuficiencia renal terminal, duplicación de la creatinina sérica, muerte por causas relacionadas con daño renal). Este estudio debería durar unos 4 años y sus resultados están diseñados para justificar el uso de una combinación de A. con un inhibidor de la ECA o un ARB para inhibir la progresión del síndrome cardiorrenal en la diabetes tipo 2. La mayor eficacia de A se puede esperar en aquellas variantes de la hipertensión, en las que hay una tendencia a aumentar la ARP (hipertensión esencial emergente, obj., síndrome metabólico, diabetes tipo 2, insuficiencia renal crónica). La gran mayoría de los pacientes con hipertensión que ya se encuentran en la primera etapa del tratamiento requieren terapia antihipertensiva combinada y, como se muestra en uno de los ensayos clínicos publicados recientemente, como parte de las combinaciones, A conserva su actividad independientemente de la ARP inicial. El aumento de la PAR en pacientes hipertensos se considera un marcador diagnóstico y un factor de riesgo independiente de eventos CV potencialmente fatales. La modulación farmacológica de ARP es uno de los enfoques más prometedores para controlar el riesgo de ECV en pacientes con HA asociada con daño renal, síndrome metabólico y obesidad. . El estudio AVOID (Aliskiren in the eValuation of proteinuria In Diabetes) (parte del programa ASPIRE HIGHER) está diseñado para evaluar el potencial de un fármaco antihipertensivo en particular en la protección de órganos diana en una variedad de situaciones caracterizadas por un riesgo muy alto de efectos potencialmente mortales. complicaciones (hipertrofia VI, DM tipo 2). , HSN). Los resultados provisionales sugieren que el bloqueo A directo de la renina es una de las estrategias más disponibles para mejorar el pronóstico a largo plazo. En el estudio ALLAY (The Aliskiren Left Ventricular Assessment of Hypertrophy), A provocó una disminución del índice de masa del miocardio del VI, reflejando la regresión de su hipertrofia, en pacientes con hipertensión y sobrepeso. La combinación de A y losartán proporcionó una disminución adicional en el índice de masa del miocardio del VI en un 20 % adicional en comparación con losartán solo, pero esta diferencia no alcanzó un valor estadísticamente significativo. Según los resultados del estudio ALOFT (ALiskiren Observation of heart Failure Treatment study), la adición de A al régimen de tratamiento estándar para la ICC con signos de mal pronóstico (aumento persistente de la concentración plasmática de péptido natriurético) e hipertensión mejoró aún más la relación de la magnitud de la regurgitación mitral al área del orificio mitral y al flujo sanguíneo transmitral. Gracias a A se logró disminuir la concentración de marcadores de activación neurohumoral desadaptativa (niveles plasmáticos de péptido natriurético cerebral y su precursor N-aminoterminal (NT-pro BNP), concentración de aldosterona en orina, ARP) . Las perspectivas para el uso de A con el fin de inhibir el desarrollo del daño renal están determinadas por su alta seguridad, obviamente significativamente superior a otros bloqueadores del SRAA (IECA, ARB y antagonistas de la aldosterona) debido a un menor riesgo de aumentar la creatininemia y el potasio. Excretado predominantemente en la bilis más que en la orina, el A conserva su efecto antihipertensivo pero no altera la función renal en pacientes con una disminución persistente de la tasa de filtración glomerular. Es en nefrología donde el bloqueo agresivo del RAAS con la ayuda de varias clases de fármacos utilizados simultáneamente puede ser eficaz en términos de prevención de la insuficiencia renal terminal. A reduce la albuminuria (significativamente superior a la monoterapia con cada uno de los fármacos) y la probabilidad de deterioro irreversible de la función renal en un grupo de pacientes (con proteinuria > 1 g/día), tal y como demuestra el estudio COOPERATE (COMbination treatment of angioOtensin BLOQUEADOR DEL RECEPTOR II E INHIBIDOR DE LA ENZIMA CONVERTIDORA DE LA ANGIOTENSINA EN LA ENFERMEDAD RENAL NO DIABÉTICA). El estudio ONTARGET (OngoiNg Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) demostró que la combinación de IECA y ARAII se asocia a una mayor probabilidad de hipotensión arterial e hiperpotasemia y, en comparación con la monoterapia con estos fármacos, se asocia a una aumento en la frecuencia de inicio del programa de hemodiálisis y una duplicación de la creatininemia en pacientes de alto riesgo con OMP. Los objetos de demostración de las propiedades nefroprotectoras de A. pueden ser las siguientes situaciones clínicas: hipertensión/síndrome metabólico o diabetes tipo 2 con albuminuria; HA asociada a una disminución persistente de la tasa de filtración glomerular; Hipertensión en enfermedad renal crónica con proteinuria (incluyendo nefrótica) y sin ella (por ejemplo, nefropatía túbulo-intersticial); hipertensión renovascular de diversos orígenes; pacientes que, por diversas razones, tienen un aumento de la creatininemia o hiperpotasemia cuando usan inhibidores de la ECA o ARB; insuficiencia renal crónica terminal, incluidos los tratados con programa de hemodiálisis o diálisis peritoneal ambulatoria permanente; receptores de trasplante renal.
Una nueva clase de medicamentos antihipertensivos (SIDA) requiere más investigación para aumentar la cantidad de evidencia para retrasar la progresión de la POM.
A, obviamente, está indicado para la mayoría de las categorías de pacientes que padecen hipertensión, y esta circunstancia se refleja en las recomendaciones rusas sobre hipertensión para el diagnóstico y tratamiento de la hipertensión (cuarta revisión, 2010) como una clase adicional de medicamentos antihipertensivos para la terapia combinada. Con el desarrollo del daño renal, A puede ser eficaz para prevenir la insuficiencia renal terminal y mejorar el pronóstico de estos pacientes.
SOBRE EL. Andreichev, Z.M. Galeeva
Universidad Estatal de Medicina de Kazan
Andreichev Nail Alexandrovich - Candidato de Ciencias Médicas, Profesor Asociado, Departamento de Terapia Docente y Cardiología
Literatura:
1. Bauer J. H., Reams G. P. Los antagonistas de los receptores de angiotensina II tipo 1. Una nueva clase de medicamentos antihipertensivos // Arch. Interno. Medicina. - 1995. - vol. 155 (13). - R. 1361-1368.
2. Kim S., Iwao H. Mecanismos moleculares y celulares de las enfermedades cardiovasculares y renales mediadas por angiotensina II // Pharmacol. Rdo. - 2000. - vol. 52(1). - R. 11-34.
3. Brown M. J. Aliskiren // Circulación. - 2008. - Vol. 118(7). - R. 773-784.
4. Nguyen G., Delarue F., Burckle C. et al. Papel fundamental del receptor de renina/prorrenina en la producción de angiotensina II y las respuestas celulares a la renina // Clin. Invertir. - 2002. - vol. 109(11). - R. 1417-1427.
5. Nussberger J., Wuerzner G., Jensen C. et al. Supresión de la angiotensina II en humanos por el inhibidor de la renina activo por vía oral Aliskiren (SPP100): comparación con enalapril // Hipertensión. - 2002. - vol. 39(1). - R. 1-8.
6. Zhao C., Vaidyanathan S., Dieterich H. A. et al. Evaluación de la interacción farmacocinética entre el inhibidor de renina directo oral aliskiren y furosemida: un estudio en voluntarios sanos // Clin. Farmacol. El r. - 2007. - vol. 81 (Suplemento 1). - S. 110 (PIII-78).
7. Gradman A.H., Kad R. Inhibición de la renina en la hipertensión // Am. Col. cardol. - 2008. - Vol. 51(5). - S. 519-528.
8. Oh B.-H., Mitchell J., Herron J.R. et al. Aliskiren, un inhibidor de la renina oral, proporciona una eficacia dependiente de la dosis y un control sostenido de la presión arterial durante 24 horas en pacientes con hipertensión // Am. Col. cardol. - 2007. - vol. 49. - S. 1157-1163.
9. Fisher N.D., Jan Danser A.H., Nussberger J. et al. Respuestas renales y hormonales a la inhibición directa de la renina con aliskireno en humanos sanos // Circulación. - 2008. - Vol. 117 (25). - S. 3199-3205.
10. Dahlo F.B., Anderson D.R., Arora V. et al. Aliskiren, un inhibidor directo de la renina, proporciona eficacia antihipertensiva y excelente tolerabilidad independientemente de la edad o el sexo en pacientes con hipertensión (resumen) // Clin. hipertensión. - 2007. - vol. 9 (Suplemento A). - SA157.
11. Andersen K., Weinberger M.H., Egan B. et al. Eficacia y seguridad comparativas de aliskiren, un inhibidor directo de la renina oral y ramipril en la hipertensión: un ensayo aleatorizado, doble ciego de 6 meses // Hipertensión. - 2008. - Vol. 26. - S. 589-599.
12. Schmieder R.E., Philipp T., Guerediaga J. et al. Eficacia antihipertensiva a largo plazo y seguridad del inhibidor oral directo de renina Aliskiren. Un ensayo comparativo aleatorizado, doble ciego de 12 meses con hidroclorotiazida // Circulación. - 2009. - Vol. 119. - S. 417-425.
13. Prescott M.F., Boye S.W., Le Breton S. et al. Eficacia antihipertensiva del inhibidor directo de la renina aliskiren cuando se agrega al tratamiento con hidroclorotiazida en pacientes con obesidad extrema e hipertensión // Am. Col. cardol. - 2007. - vol. 49 (9, Suplemento A). - S. 370A. - (pág. 1014-169).
14. Persson F., Rossing P., Schjoedl K.J. et al. Evolución temporal de los efectos antiproteinúricos y antihipertensivos de la inhibición directa de la renina en la diabetes tipo 2 // Kidney Int. - 2008. - Vol. 73(12). - S. 1419-1425.
15. Parving H.H., Persson F., Lewis J.B. et al. EVITE a los investigadores del estudio. Aliskiren combinado con losartán en diabetes tipo 2 y nefropatía // N. Engl. J.Med. - 2008. - Vol. 358 (23). - S. 2433-2446.
16. Jordan J., Engli S., Boye S.W. et al. Inhibición directa de renina con aliskiren en pacientes obesos con hipertensión arterial // Hipertensión arterial. - 2007. - vol. 49. - P. 1-9.
17. Uresina Y., Taylor A., Kilo C. et al. Eficacia y seguridad del inhibidor directo de renina aliskiren y ramipril solos o en combinación en pacientes con diabetes e hipertensión // Renina. Angiotensina Aldosterona Syst. - 2007. - vol. 8.- S. 190-198.
18. Oparil S., Yarrows S., Patel S. et al. Eficacia y seguridad del uso combinado de aliskireno y valsartán en pacientes con hipertensión: un ensayo aleatorizado, doble ciego // Lancet. - 2007. - vol. 370. - S. 221-229.
19. Drummond W., Munger M.A., Essop M.R. et al. Eficacia antihipertensiva del inhibidor de renina directo oral aliskiren como terapia adicional en pacientes que no responden a la monoterapia con amlodipino // Clin. hipertensión. - 2007. - vol. 9.- S. 742-750.
20. Chrysant SG, Murray AV, Hoppe UC et al. Seguridad, tolerabilidad y eficacia a largo plazo de aliskiren en combinación con valsartán en pacientes con hipertensión: un análisis intermedio de 6 meses // Curr. Medicina. Res. Opinión - 2008. - Vol. 24(4). - S. 1039-1047.
21. Ensayo de aliskiren en diabetes tipo 2 con criterios de valoración cardiorrenales (ALTITUDE): justificación y diseño del estudio // Nephrol Dial Transplant. - 2009. - Vol. 24(5). - S. 1663-1671.
22. Stanton AV, Dicker P., O'Brien E.T. La monoterapia con aliskiren da como resultado la mayor y menor reducción de la presión arterial en pacientes con niveles basales de PRA altos y bajos, respectivamente // Am. J. Hipertensión. - 2009. - Vol. 22.- S. 954-957.
23. Mukhin N. A., Fomin V. V. Actividad de renina plasmática: un factor de riesgo y un objetivo independiente de la terapia antihipertensiva: el papel de aliskiren // Consilium Medicum. - T. 11. - 2009. - Nº 10. - S. 3-6.
24. Solomon SD, Appelbaum E., Manning W.J. et al. Efecto del inhibidor directo de renina Aliskiren, ya sea solo o en combinación con losartán, en comparación con losartán, sobre la masa ventricular izquierda en pacientes con hipertensión e hipertrofia ventricular izquierda // El ensayo Aliskiren Left Ventricular Assessment of Hypertrophy (ALLAY). Presentado al Colegio Americano de Cardiología. 57ª Sesión Científica Anual, 31 de marzo de 2008.
25. Mc. Murray JV, Pitt B., Latini R. et al. Efectos del inhibidor de renina directo oral aliskiren en pacientes con insuficiencia cardíaca sintomática // Insuficiencia cardíaca circulatoria. - 2008. - Vol. 1.- S. 17-24.
26. Nakao N., Yoshimura A., Morita H. et al. Tratamiento combinado del bloqueador del receptor de angiotensina-II y el inhibidor de la enzima convertidora de angiotensina en la enfermedad renal no diabética (COOPERATE): un ensayo controlado aleatorio // Lancet. - 2003. - vol. 361 (9352). - S. 117-124.
27. Mann I.F., Schmieder R.E., Mc.Queen M. et al. Resultados renales con telmisartán, ramipril o ambos, en personas con alto riesgo vascular (el estudio ONTARGET): un ensayo controlado, aleatorizado, doble ciego y multicéntrico // Lancet. - 2008. - Vol. 372 (9638). - S. 547-553.
28. Chazova I.E., Fomin V.V., Paltseva E.M. Inhibidor directo de renina aliskireno - nuevas posibilidades para proteger los riñones en la hipertensión arterial // Nefrología Clínica. - N° 1. - 2009. - C. 44-49.
29. Chazova I.E., Fomin V.V. Inhibidor directo de renina aliskiren: posibilidades de corrección del síndrome cardio-renal // Hipertensión sistémica. - 2009. - Nº 4. - C. 53-58.
30. Diagnóstico y tratamiento de la hipertensión arterial: recomendaciones rusas // Hipertensión sistémica. - 2010. - N° 3. - C. 5-26.
03.07.2012
386 Vistas
Con hipertensión arterial (hipertensión), aumenta la cantidad de enzima Renina en la sangre. Esto conduce a un aumento persistente y prolongado en la cantidad de proteína Angiotensina 2 en la sangre y los tejidos del cuerpo.La angiotensina 2 tiene un efecto vasoconstrictor, promueve la retención de sodio y agua en el cuerpo, lo que conduce a un aumento de la presión arterial. Un nivel alto de angiotensina 2 en la sangre y los tejidos durante mucho tiempo provoca un aumento persistente de la presión arterial, es decir, hipertensión arterial. Inhibidor de renina: un medicamento que se combina con renina, como resultado de lo cual, la renina se neutraliza y pierde actividad enzimática. Esto conduce interconectadamente a una disminución en el nivel de angiotensina 2 en la sangre y los tejidos, a una disminución de la presión arterial.
AT2 tiene un efecto vasoconstrictor, promueve la retención de sodio y agua en el cuerpo. Esto conduce a un aumento y un aumento en el volumen de sangre circulante. En segundo lugar, hay un aumento en la fuerza de las contracciones del corazón. Todo esto en total provoca un aumento de la (TA) tanto sistólica (superior) como diastólica (inferior). Cuanto mayor sea el nivel de renina en la sangre, cuanto mayor sea el nivel de AT2 en la sangre, mayor será la presión arterial.
La secuencia de transformaciones enzimáticas: Renina + Angiotensinógeno = Angiotensina 1 + ACE = Angiotensina 2, se denomina Sistema Renina-Angiotensina (RAS) o Sistema Renina-Angiotensina-Aldosterona (SRAA). Por activación (aumento de la actividad) del RAS se entiende un aumento en el nivel sanguíneo de renina, AT2.
Un alto nivel de renina en la sangre conduce a un aumento del nivel de AT2 en la sangre y los tejidos. Un alto nivel de AT2 en la sangre y los tejidos durante mucho tiempo provoca un aumento persistente de la presión arterial, es decir, -.
Una disminución en el nivel de renina en la sangre conduce a una disminución en el nivel de AT2 en la sangre y los tejidos, a una disminución de la presión arterial.
inhibidor de renina- una sustancia medicinal que entra en combinación con la renina, como resultado de lo cual la renina se neutraliza, pierde su actividad enzimática y la actividad enzimática de la renina en la sangre disminuye. La renina unida a un inhibidor de renina pierde su capacidad para escindir el angiotensinógeno en AT1. Al mismo tiempo, hay una disminución interconectada en el nivel de AT2 en la sangre y los tejidos: una disminución de la presión arterial, una disminución de la actividad del RAS, una mejora en el flujo sanguíneo, el suministro de sangre a los órganos y tejidos del cuerpo.
Aliskirén es actualmente el primer y único inhibidor de Renina con el que se han realizado todas las etapas de los ensayos clínicos y que se recomienda para el tratamiento de la hipertensión arterial desde 2007.
sustancia medicinal Aliskirén producido por la industria farmacéutica bajo nombres comerciales (comerciales):
- Rasilez en forma de un medicamento simple que contiene solo una sustancia farmacológica: Aliskiren;
- Ko Rasilez en forma de un fármaco combinado (complejo) que contiene dos fármacos: el inhibidor de la renina Aliskiren y el fármaco diurético hidroclorotiazida (salurético, diurético tiazídico).
Puede dejar sus opiniones y comentarios sobre el uso del inhibidor de renina Aliskiren para el tratamiento de la hipertensión arterial a continuación.
