לציטוט: Leonova M.V. תרופות חדשות ומבטיחות החוסמות את מערכת הרנין-אנגיוטנסין-אלדוסטרון // RMJ. סקירה רפואית. 2013. מס' 17. ש' 886
תפקידה של מערכת הרנין-אנגיוטנסין-אלדוסטרון (RAAS) בהתפתחות יתר לחץ דם עורקי (AH) ומחלות לב וכלי דם אחרות נחשב כיום לדומיננטי. ברצף הקרדיווסקולרי, יתר לחץ דם הוא בין גורמי הסיכון, והמנגנון הפתופיזיולוגי העיקרי של פגיעה במערכת הלב וכלי הדם הוא אנגיוטנסין II (ATII). ATII הוא מרכיב מרכזי ב-RAAS - אפקטור המיישם כיווץ כלי דם, שימור נתרן, הפעלת מערכת העצבים הסימפתטית, ריבוי תאים והיפרטרופיה, התפתחות של עקה חמצונית ודלקת של דופן כלי הדם.
נכון להיום, כבר פותחו שני סוגים של תרופות החוסמות את ה-RAAS ונמצא בשימוש קליני נרחב - מעכבי ACE וחוסמי קולטן ATII. ההשפעות הפרמקולוגיות והקליניות של מחלקות אלה שונות. ACE הוא אבץ מטלופרוטאינאז פפטידאז אשר מבצע חילוף חומרים של ATI, AT1-7, ברדיקינין, חומר P ופפטידים רבים אחרים. מנגנון הפעולה של מעכבי ACE קשור בעיקר למניעת היווצרות ATII, המעודד הרחבת כלי דם, נטריאוזיס ומבטל את ההשפעות הפרו-דלקתיות, ההתרבותיות ואחרות של ATII. בנוסף, מעכבי ACE מונעים את הפירוק של ברדיקינין ומעלים את רמתו. ברדיקינין הוא מרחיב כלי דם רב עוצמה, הוא מגביר את הנטריאוזיס, והכי חשוב, יש לו קרדיו-פרוטקטיבי (מונע היפרטרופיה, מפחית נזק איסכמי בשריר הלב, משפר את אספקת הדם הכלילי) ופעילות מגוננת על כלי הדם, משפר את תפקוד האנדותל. יחד עם זאת, רמה גבוהה של ברדיקינין היא הגורם להתפתחות אנגיואדמה, שהיא אחד החסרונות החמורים של מעכבי ACE, אשר מעלים משמעותית את רמת הקינינים.
מעכבי ACE לא תמיד מסוגלים לחסום לחלוטין את היווצרות ATII ברקמות. כעת הוכח כי אנזימים אחרים שאינם קשורים ל-ACE, בעיקר אנדופפטיזים, שאינם מושפעים ממעכבי ACE, יכולים גם הם להשתתף בהפיכתו ברקמות. כתוצאה מכך, מעכבי ACE אינם יכולים לבטל לחלוטין את ההשפעות של ATII, אשר עשויה להיות הסיבה לחוסר היעילות שלהם.
הפתרון לבעיה זו הוקל על ידי גילוי קולטני ATII והמעמד הראשון של תרופות החוסמות באופן סלקטיבי את קולטני AT1. באמצעות קולטני AT1 מתממשות ההשפעות השליליות של ATII: כיווץ כלי דם, הפרשת אלדוסטרון, וזופרסין, נוראדרנלין, אגירת נוזלים, שגשוג של תאי שריר חלקים וקרדיומיוציטים, הפעלת SAS, כמו גם מנגנון המשוב השלילי - יצירת רנין . קולטני AT2 מבצעים פונקציות "מועילות", כגון הרחבת כלי דם, תהליכי תיקון והתחדשות, פעולה אנטי-פרוליפרטיבית, התמיינות והתפתחות רקמות עובריות. ההשפעות הקליניות של חוסמי קולטני ATII מתווכות באמצעות סילוק ההשפעות ה"מזיקות" של ATII ברמה של קולטני AT1, מה שמספק חסימה מלאה יותר של ההשפעות השליליות של ATII והגברת ההשפעה של ATII על קולטני AT2. , המשלים את ההשפעות מרחיבות כלי דם ואנטי-התרבות. לחסמי קולטן ATII יש השפעה ספציפית על ה-RAAS מבלי להפריע למערכת הקינין. חוסר ההשפעה על פעילות מערכת הקינין, מחד גיסא, מפחית את חומרת התופעות הלא רצויות (שיעול, אנגיואדמה), אך מאידך מונע מחוסמי קולטן ATII השפעה אנטי-איסכמית והגנה מפני כלי דם. מה שמבדיל אותם ממעכבי ACE. מסיבה זו, האינדיקציות לשימוש בחוסמי קולטן ATII חוזרות ברובן על ההתוויות למינוי מעכבי ACE, מה שהופך אותן לתרופות חלופיות.
למרות הכנסתם של חוסמי RAAS לתרגול הנרחב של טיפול ביתר לחץ דם, נותרו בעיות של שיפור התוצאות והפרוגנוזה. אלה כוללים: אפשרות לשפר את בקרת לחץ הדם באוכלוסייה, יעילות הטיפול ביתר לחץ דם עמיד, אפשרות להפחית עוד יותר את הסיכון למחלות לב וכלי דם.
החיפוש אחר דרכים חדשות להשפיע על ה-RAAS נמשך באופן פעיל; מערכות אחרות בעלות אינטראקציה הדוקה נחקרות ומפותחות תרופות בעלות מנגנוני פעולה מרובים, כגון מעכבי ACE ומעכבי אנדופפטיז (NEP), אנזים הממיר אנדותלין (EPF) ומעכבי NEP, מעכבי ACE/NEP/EPF.
מעכבי Vasopeptidase
בנוסף ל-ACE הידוע, vasopeptidases כוללים 2 אבץ metalloproteinases אחרים - neprilysin (אנדופפטידאז נייטרלי, NEP) ואנזים ממיר אנדותלין, שיכולים להיות גם מטרות להשפעות תרופתיות.
Neprilysin הוא אנזים המיוצר על ידי האנדותל של כלי הדם ומעורב בפירוק של פפטיד נטריאורטי, כמו גם ברדיקינין.
מערכת הפפטידים הנטרי-אורטית מיוצגת על ידי שלושה איזופורמים שונים: פפטיד נטרי-אורטי פרוזדורי (סוג A), פפטיד נטרי-אורטי במוח (סוג B), אשר מסונתזים באטריום ובשריר הלב, ופפטיד C אנדותל, שהם מעכבי RAAS אנדוגניים ב הפונקציות הביולוגיות שלהם ואנדותלין-1 (טבלה 1). ההשפעות הקרדיווסקולריות והכליותיות של פפטיד נטריאורטי הן להפחית את לחץ הדם באמצעות ההשפעה על טונוס כלי הדם ומאזן המים והאלקטרוליטים, וכן בהשפעות אנטי-פרוליפרטיביות ואנטי-פיברוטיות על איברי המטרה. לאחרונה, מערכת הפפטידים הנטריאורטית מעורבת בוויסות מטבולי של חמצון שומנים, היווצרות והתמיינות של אדיפוציטים, הפעלת אדיפונקטין, הפרשת אינסולין וסבילות לפחמימות, העשויות להעניק הגנה מפני התפתחות התסמונת המטבולית.
עד כה נודע כי התפתחות מחלות לב וכלי דם קשורה לחוסר ויסות של מערכת הפפטידים הנטריאורטית. אז, ביתר לחץ דם, קיים מחסור בפפטיד נטרי-אורטי, המוביל לרגישות למלח ולפגיעה ב-natriuresis; באי ספיקת לב כרונית (CHF), על רקע מחסור, נצפה תפקוד לא תקין של ההורמונים של מערכת הפפטידים הנטריאורטית.
לכן, ניתן להשתמש במעכבי NEP כדי להעצים את מערכת הפפטידים הנטרי-אורטית על מנת להשיג השפעות נוספות של ירידת לחץ דם ומגנה על הלב. עיכוב של neprilysin מוביל להגברת ההשפעות הנטריאורטיות, המשתנות והרחבת כלי הדם של פפטיד אנדוגני נטריאורטי, וכתוצאה מכך לירידה בלחץ הדם. עם זאת, NEP מעורב גם בפירוק של פפטידים כלי דם אחרים, בפרט ATI, ATII ואנדותלין-1. לכן, מאזן ההשפעות על טונוס כלי הדם של מעכבי NEP משתנה ותלוי בדומיננטיות של השפעות מכווצות והרחבות. בשימוש ממושך, ההשפעה נגד יתר לחץ דם של מעכבי נפריליזין מתבטאת בצורה חלשה עקב הפעלה מפצה של היווצרות ATII ואנדותלין-1.
בהקשר זה, השילוב בין ההשפעות של מעכבי ACE ומעכבי NEP יכול להעצים משמעותית השפעות המודינמיות ואנטי-פרוליפרטיביות כתוצאה ממנגנון פעולה משלים, שהוביל ליצירת תרופות בעלות מנגנון פעולה כפול, המאוחדות תחת השם. - מעכבי vasopeptidase (טבלה 2, איור 1).
מעכבים ידועים של vasopeptidases מאופיינים בדרגות שונות של סלקטיביות עבור NEP/ACE: omapatrilat - 8.9:0.5; פזידופרילט - 5.1:9.8; sampatrilat - 8.0:1.2. כתוצאה מכך, מעכבי vasopeptidase קיבלו הזדמנויות גדולות בהרבה להשגת אפקט לחץ דם נמוך, ללא קשר לפעילות ה-RAAS ורמת שימור הנתרן, ובהגנה על איברים (רגרסיה של היפרטרופיה, אלבומינוריה, נוקשות כלי דם). הנחקר ביותר במחקרים הקליניים היה omapatrilat, שהראה יעילות גבוהה יותר להורדת לחץ דם בהשוואה למעכבי ACE, ובמטופלים עם CHF הובילה לעלייה בשבר הפליטה ולשיפור התוצאות הקליניות (מחקרי IMPRESS, OVERTURE), אך ללא יתרונות על פני מעכבי ACE.
עם זאת, בניסויים קליניים גדולים עם שימוש באומפטרלט, נמצאה שכיחות גבוהה יותר של אנגיואדמה בהשוואה למעכבי ACE. ידוע ששכיחות אנגיואדמה בשימוש במעכבי ACE היא בין 0.1 ל-0.5% באוכלוסייה, מתוכם 20% מהמקרים מסכני חיים, מה שקשור לעלייה מרובה בריכוזי ברדיקינין ומטבוליטים שלו. תוצאות מחקר רב-מרכזי גדול OCTAVE (n=25,302), אשר תוכנן במיוחד לחקור את שכיחות אנגיואדמה, הראו כי השכיחות של תופעת לוואי זו במהלך הטיפול באומפטריל עולה על זו שבקבוצת האנלפריל - 2.17% לעומת 0.68% (סיכון יחסי 3.4). זה הוסבר על ידי ההשפעה המוגברת על רמת הקינינים במהלך עיכוב סינרגטי של ACE ו-NEP, הקשורה לעיכוב של aminopeptidase P, המעורב בפירוק ברדיקינין.
מעכב וזופפטידאז כפול ACE/NEP חדשני, אילפטריל, בעל זיקה גבוהה יותר ל-ACE מאשר ל-NEP. כאשר חקרו את ההשפעות הפרמקודינמיות של אילפטריל על ההשפעה על פעילות ה-RAAS והפפטיד הנטריאורטי אצל מתנדבים בריאים, נמצא כי התרופה מדכאת באופן תלוי מינון (במינונים של 5 ו-25 מ"ג) ובאופן משמעותי (יותר מ-88%). ACE בפלזמה במשך יותר מ-48 שעות, ללא קשר לרגישות למלח. במקביל, התרופה העלתה משמעותית את פעילות הרנין בפלזמה למשך 48 שעות והפחיתה את רמת האלדוסטרון. תוצאות אלו הראו דיכוי בולט וארוך יותר של ה-RAAS, בניגוד למעכב ACE ramipril במינון של 10 מ"ג, אשר הוסבר על ידי השפעת רקמות משמעותית יותר של ilepatril על ACE וזיקה גדולה יותר ל-ACE, וברמה דומה. של חסימה של RAAS בהשוואה לשילוב של irbesartan 150 מ"ג + 10 מ"ג ramipril. בניגוד להשפעה על ה-RAAS, השפעת אילפטריל על הפפטיד הנטריאורטי התבטאה בעלייה חולפת ברמת הפרשתו בתקופה של 4-8 שעות לאחר מינון של 25 מ"ג, מה שמעיד על זיקה נמוכה וחלשה יותר. עבור NEP ומבדיל אותו מאומפטרלט. יתרה מכך, מבחינת רמת הפרשת האלקטרוליטים, לתרופה אין השפעה נטריאורטית נוספת בהשוואה לרמיפריל או לאירבסארטן, כמו גם מעכבי vasopeptidase אחרים. ההשפעה המקסימלית של לחץ דם נמוך מתפתחת 6-12 שעות לאחר נטילת התרופה, והירידה בלחץ הדם הממוצע היא 5±5 ו-10±4 מ"מ כספית. ברגישות נמוכה וגבוהה למלח, בהתאמה. על פי המאפיינים הפרמקוקינטיים, ilepatril הוא פרו-תרופה עם מטבוליט פעיל, שנוצר במהירות בריכוז מקסימלי תוך 1-1.5 שעות ומסלק באיטיות. ניסויים קליניים שלב III נערכים כעת.
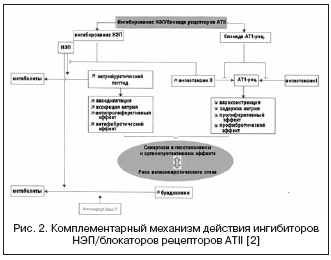
מסלול חלופי לדיכוי כפול של RAAS ו-NEP מיוצג על ידי שילוב של חסימה של קולטני ATII ו-NEP (איור 2). חוסמי קולטן ATII אינם משפיעים על חילוף החומרים של קינינים, בניגוד למעכבי ACE, ולכן יש להם סיכון נמוך יותר לפתח אנגיואדמה. נכון לעכשיו, התרופה הראשונה, חוסם קולטן ATII בעל השפעה של עיכוב NEP ביחס של 1:1, LCZ696, עוברת ניסויים קליניים שלב III. מולקולת התרופה המשולבת מכילה valsartan ומעכב NEP (AHU377) בצורה של פרו-תרופה. במחקר גדול בחולים עם יתר לחץ דם (n=1328), LCZ696 במינונים של 200-400 מ"ג הראה יתרון בהשפעה של לחץ דם נמוך על פני valsartan במינונים של 160-320 מ"ג בצורה של ירידה נוספת בלחץ הדם ב-5 /3 ו-6/3 מ"מ כספית. . . ההשפעה על לחץ הדם של LCZ696 לוותה בירידה בולטת יותר בלחץ הדופק: ב-2.25 ו-3.32 מ"מ כספית. במינונים של 200 ו-400 מ"ג, בהתאמה, הנחשב כיום כגורם פרוגנוסטי חיובי להשפעה על קשיחות דופן כלי הדם ותוצאות קרדיווסקולריות. במקביל, המחקר של סמנים ביולוגיים נוירו-הומורליים במהלך הטיפול ב-LCZ696 הראה עלייה ברמת הפפטיד הנטריאורטי עם דרגת עלייה דומה ברמת הרנין והאלדוסטרון בהשוואה לוולסרטן. הסבילות בחולים עם יתר לחץ דם הייתה טובה, ולא צוינו מקרים של אנגיואדמה. ניסוי PARAMOUMT הושלם כעת ב-685 חולים עם CHF ו-EF ללא הפרעות. תוצאות המחקר הראו ש-LCZ696 מפחית את רמת ה-NT-proBNP מהר יותר ובולט יותר (נקודת הסיום העיקרית היא סמן של פעילות פפטיד נטוורטית מוגברת ופרוגנוזה גרועה ב-CHF) בהשוואה לוולסרטן, וגם מפחית את גודל הפרוזדור השמאלי. , מה שמעיד על נסיגה של העיצוב מחדש שלו. מחקר בחולים עם CHF ו-EF מופחת מתקיים (מחקר PARADIGM-HF).
מעכבי מערכת האנדותלין
למערכת האנדותלין תפקיד חשוב בוויסות טונוס כלי הדם וזרימת הדם האזורית. מבין שלושת האיזופורמים הידועים, אנדותלין-1 הוא הפעיל ביותר. בנוסף להשפעות מכווצות כלי הדם הידועות, אנדותלין ממריץ את השגשוג והסינתזה של המטריצה הבין-תאית, וגם, עקב השפעה ישירה על הטון של כלי הכליה, מעורב בוויסות הומאוסטזיס של מים ואלקטרוליטים. ההשפעות של אנדותלין מתממשות באמצעות אינטראקציה עם קולטנים מסוג A וסוג B ספציפיים, שתפקודיהם מנוגדים זה לזה: כיווץ כלי הדם מתרחש דרך הקולטנים מסוג A, והרחבת כלי הדם מתרחשת דרך סוג B. בשנים האחרונות הוכח כי לקולטנים מסוג B יש תפקיד חשוב בפינוי אנדותלין-1, כלומר. חסימה של קולטנים אלו משבשת את הפינוי התלוי בקולטן של אנדותלין-1 ומגבירה את ריכוזו. בנוסף, קולטנים מסוג B מעורבים בוויסות ההשפעות הכליות של אנדותלין-1 ובשמירה על הומאוסטזיס מים ואלקטרוליטים, שהיא חשובה.
נכון לעכשיו, תפקידו של האנדותלין הוכח בהתפתחות של מספר מחלות, כולל. AH, CHF, יתר לחץ דם ריאתי, מחלת כליות כרונית; מראה קשר הדוק בין רמת האנדותלין ותסמונת מטבולית, הפרעה בתפקוד האנדותל והאטרוגנזה. מאז שנות ה-90 מתבצע חיפוש אחר אנטגוניסטים לקולטן אנדותלין המתאימים לשימוש קליני; כבר ידועות 10 תרופות ("סנטנים") עם דרגות שונות של סלקטיביות לקולטנים מסוג A/B. האנטגוניסט הראשון לקולטן אנדותלין הלא סלקטיבי - בוסנטן - במחקר קליני בחולים עם יתר לחץ דם הראה יעילות נמוכה של לחץ דם דומה לזו של מעכב ACE אנלפריל. מחקרים נוספים על יעילותם של אנטגוניסטים לאנדותלין ליתר לחץ דם הראו את הרלוונטיות הקלינית שלהם בטיפול ביתר לחץ דם עמיד ובסיכון קרדיווסקולרי גבוה. נתונים אלו התקבלו בשני ניסויים קליניים גדולים DORADO (n=379) ו- DORADO-AC (n=849), שבהם נוספה Darusentan לטיפול משולב משולש בחולים עם יתר לחץ דם עמיד. במחקר DORADO, חולים עם יתר לחץ דם עמיד היו קשורים למחלת כליות כרונית ולפרוטאינוריה, וכתוצאה מתוספת של דארוסנטן נצפתה לא רק ירידה משמעותית בלחץ הדם, אלא גם ירידה בהפרשת החלבון. ההשפעה האנטי-פרוטאינורית של אנטגוניסטים לקולטן אנדותלין אושרה לאחר מכן במחקר בחולים עם נפרופתיה סוכרתית המשתמשים באבוקנטן. עם זאת, במחקר DORADO-AC, לא היה יתרון בהפחתת לחץ דם נוספת על פני משווים ופלסבו, וזו הייתה הסיבה להפסקת מחקרים נוספים. בנוסף, ב-4 מחקרים גדולים של אנטגוניסטים לאנדותלין (בוסנטן, דארוסנטן, אנרסנטן) בחולים עם CHF, התקבלו תוצאות סותרות, אשר הוסברו בעלייה בריכוז האנדותלין-1. מחקר נוסף של אנטגוניסטים לקולטן אנדותלין הושעה עקב השפעות שליליות הקשורות לאגירת נוזלים (בצקת היקפית, עומס נפח). התפתחות ההשפעות הללו קשורה להשפעה של אנטגוניסטים לאנדותלין על קולטנים מסוג B, ששינתה את החיפוש אחר תרופות המשפיעות על מערכת האנדותלין דרך מסלולים אחרים; ולאנטגוניסטים של קולטן אנדותלין יש כיום רק אינדיקציה אחת, טיפול ביתר לחץ דם ריאתי.
בהתחשב בחשיבות הגבוהה של מערכת האנדותלין בוויסות טונוס כלי הדם, מתבצע חיפוש אחר מנגנון פעולה נוסף באמצעות vasopeptidase - EPF, המעורב ביצירת אנדותלין-1 פעיל (איור 3). חסימת ACE והשילוב עם עיכוב NEP יכולים לדכא ביעילות את היווצרות אנדותלין-1 ולהעצים את ההשפעות של הפפטיד הנטריאורטי. היתרונות של מנגנון פעולה כפול הם, מצד אחד, במניעת החסרונות של מעכבי NEP הקשורים להתכווצות כלי דם אפשרית בתיווך הפעלת אנדותלין, מצד שני, הפעילות הנטריאורטית של מעכבי NEP מאפשרת לפצות על אצירת נוזלים. קשור לחסימה לא סלקטיבית של קולטני אנדותלין. Daglutril הוא מעכב כפול של NEP ו-EPF, שנמצא בשלב II של ניסויים קליניים. מחקרים הראו השפעות מגנות לב לב בולטות של התרופה עקב ירידה בשיפוץ הלב וכלי הדם, נסיגה של היפרטרופיה ופיברוזיס.
מעכבי רנין ישירים
ידוע כי מעכבי ACE וחוסמי קולטן ATII מגבירים את פעילות הרנין על ידי מנגנון משוב, וזו הסיבה לבריחת היעילות של חוסמי RAAS. רנין מייצג את הצעד הראשון במפל RAAS; הוא מיוצר על ידי התאים ה-juxtaglomerular של הכליות. רנין דרך אנגיוטנזינוגן מקדם יצירת ATII, כיווץ כלי דם והפרשת אלדוסטרון, וגם מסדיר את מנגנוני המשוב. לכן, עיכוב רנין מאפשר להשיג חסימה מלאה יותר של מערכת ה-RAAS. החיפוש אחר מעכבי רנין נמשך מאז שנות ה-70; במשך זמן רב, לא ניתן היה להשיג צורה פומית של מעכבי רנין בשל הזמינות הביולוגית הנמוכה שלהם במערכת העיכול (פחות מ-2%). מעכב הרנין הישיר הראשון המתאים למתן דרך הפה, אלישקירן, נרשם בשנת 2007. לאליסקרן זמינות ביולוגית נמוכה (2.6%), זמן מחצית חיים ארוך (24-40 שעות), דרך סילוק חוץ-כליתית. הפרמקודינמיקה של אלישקירן קשורה לירידה של 80% ברמת ATII. במחקרים קליניים בחולים עם יתר לחץ דם, אליסקירן במינונים של 150-300 מ"ג ליום הובילו לירידה ב-SBP ב-8.7-13 ו-14.1-15.8 מ"מ כספית. בהתאמה, ו-DBP - ב-7.8-10.3 ו-10.3-12.3 מ"מ כספית. . ההשפעה של hypotensive של aliskiren נצפתה בתת-קבוצות שונות של חולים, כולל חולים עם תסמונת מטבולית, השמנת יתר; במונחים של חומרה, זה היה דומה להשפעה של מעכבי ACE, חוסמי קולטן ATII, וצוינה השפעה נוספת בשילוב עם valsartan, hydrochlorothiazide ואמלודיפין. מספר מחקרים קליניים הראו השפעות אורגניות של התרופה: השפעה אנטי-פרוטאינורית בחולים עם נפרופתיה סוכרתית (מחקר AVOID, n=599), נסיגה של היפרטרופיה של חדר שמאל בחולים עם יתר לחץ דם (מחקר ALLAY, n=465). לפיכך, במחקר AVOID, לאחר 3 חודשים של טיפול בלוסארטן במינון של 100 מ"ג ליום והגעה לרמת היעד של לחץ הדם (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
בנוסף, נערכת סדרת מחקרים קליניים של אלישקירן בטיפול במחלות לב וכלי דם אחרות עם הערכה של ההשפעה על הפרוגנוזה של החולים: ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n) =7000) מחקרים בחולים עם CHF, מחקר ALTITUDE בחולים עם סוכרת וסיכון קרדיווסקולרי גבוה, מחקר ASPIRE בחולים עם שיפוץ לאחר אוטם.
סיכום
כדי לפתור את הבעיות של מניעת מחלות לב וכלי דם, נמשכת יצירתן של תרופות חדשות בעלות מנגנון פעולה מרובה מורכב, המאפשרת חסימה מלאה יותר של ה-RAAS באמצעות מפל מנגנונים של ויסות המודינמי ונוירו-הומורלי. ההשפעות הפוטנציאליות של תרופות כאלה מאפשרות לא רק לספק אפקט נוסף להורדת לחץ דם, אלא גם להשיג שליטה ברמות לחץ הדם בחולים בסיכון גבוה, כולל יתר לחץ דם עמיד. תרופות בעלות מנגנון פעולה מרובה מראות יתרונות בהשפעה אורגנית בולטת יותר, שתמנע נזק נוסף למערכת הלב וכלי הדם. לימוד היתרונות של תרופות חדשות החוסמות את ה-RAAS דורש מחקר והערכה נוספים של השפעתן על הפרוגנוזה של חולים עם יתר לחץ דם ומחלות לב וכלי דם אחרות.



סִפְרוּת
1 קמפבל D.J. עיכוב Vasopeptidase: חרב פיפיות? // יתר לחץ דם. 2003 כרך. 41. עמ' 383-389.
2. Laurent S., Schlaich M., Esler M. תרופות חדשות, נהלים והתקנים ליתר לחץ דם // Lancet. 2012. כרך. 380. עמ' 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. מעכבי Vasopeptidase: מושג טיפולי חדש במחלות לב וכלי דם? // מחזור. 2001 כרך 104. עמ' 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. עיכוב אנדופפטידאז ניטרלי ומערכת הפפטידים הנטריאורטית: אסטרטגיה מתפתחת בטיפולים קרדיווסקולריים // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. השוואה של מעכבי vasopeptidase, omapatrilat וליזינופריל על סובלנות ותחלואה בפעילות גופנית בחולים עם אי ספיקת לב: ניסוי אקראי של IMPRESS // Lancet. 2000 כרך 356. עמ' 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. השוואה של omapatrilat ו-enalapril בחולים עם אי ספיקת לב כרונית: The Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002 כרך 106. עמ' 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. חוסמי קולטן לאנגיוטנסין II בחולים עם אנגיואדמה הנגרמת על ידי מעכבי ACE // אן. פרמקוטר. 2000 כרך 34. עמ' 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat ו-enalapril בחולים עם יתר לחץ דם: הניסוי Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) // Am. J. Hypertens. 2004 כרך 17. עמ' 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. פרמקוקינטיקה ופרמקודינמיקה של מעכב vasopeptidase AVE7688 בבני אדם // Clin. פרמקול. ת'ר. 2006 כרך. 79. עמ' 49-61.
10. Gu J., Noe A., Chandra P. et al. פרמקוקינטיקה ופרמקודינמיקה של LCZ696, מעכב רצפטורנפריליזין אנגיוטנסין דו-אקטיטיבי (ARNi) // J. Clin. פרמקול. 2010 כרך. 50. עמ' 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. הפחתת לחץ דם עם LCZ696, מעכב דו-אקטיב חדש של הקולטן לאנגיוטנסין II ונפריליזין: מחקר אקראי, כפול סמיות, מבוקר פלצבו, מחקר משווה פעיל // Lancet. 2010 כרך. 375. עמ' 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. מעכב הקולטן לאנגיוטנסין neprilysin LCZ696 באי ספיקת לב עם מקטע פליטה משומר: ניסוי אקראי מבוקר כפול סמיות שלב 2 // Lancet. 2012. כרך. 380(9851). עמ' 1387-1395.
13. לוין א.ר. אנדותלינים // N. Engl. J. Med. 1995 כרך. 333. עמ' 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. תפקידו של אנדותלין-1 ביתר לחץ דם קליני: 20 שנה לאחר // יתר לחץ דם. 2008 כרך. 52. עמ' 452-459.
15. Burnier M., Forni V. אנטגוניסטים לקולטן אנדותלין: מקום בניהול יתר לחץ דם חיוני? // נפרול. חוּגָה. לְהַשְׁתִיל. 2011.0:1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. ההשפעה של אנטגוניסט לקולטן אנדותלין, בוסנטן, על לחץ הדם בחולים עם יתר לחץ דם חיוני. חוקרי יתר לחץ דם Bosentan // N. Engl. J. Med. 1998 כרך 338. עמ' 784-790.
17. Weber M.A., Black H., Bakris G. et al. אנטגוניסט סלקטיבי לקולטן אנדותלין להפחתת לחץ דם בחולים עם יתר לחץ דם עמיד לטיפול: ניסוי אקראי, כפול סמיות, מבוקר פלצבו // Lancet. 2009 כרך. 374. עמ' 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. תוצאות שונות באמצעות לחץ דם מרפאתי ואמבולטורי: דיווח על ניסוי יתר לחץ דם עמיד לדרוסנטן // יתר לחץ דם. 2010 כרך. 56. עמ' 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan עבור נפרופתיה סוכרתית גלויה // J. Am. soc. נפרול. 2010 כרך. 21. עמ' 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. אנזים הממיר אנדותלין/מעכב אנדופפטידאז נייטרלי SLV338 מונע שיפוץ לב יתר לחץ דם באופן בלתי תלוי בלחץ דם // יתר לחץ דם. 2011 כרך 57. עמ' 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. דיכוי אנגיוטנסין II בבני אדם על ידי מעכב רנין פעיל תיאורטית Aliskiren (SPP100): השוואה לאנלפריל // יתר לחץ דם. 2002 כרך 39(1). עמ' E1-8.
22. Alreja G., Joseph J. Renin ומחלות לב וכלי דם: דרך שחוקה, או כיוון חדש? // World J. Cardiol. 2011 כרך 3(3). עמ' 72-83.
23. אינגלפינגר J.R. Aliskiren וטיפול כפול בסוכרת מסוג 2 // N. Engl. J. Med. 2008 כרך. 358(23). עמ' 2503-2505.
24. Pouleur A.C., Uno H., Prescott M.F., Desai A. (עבור חוקרי ALLAY). דיכוי אלדוסטרון מתווך נסיגה של היפרטרופיה של חדר שמאל בחולים עם יתר לחץ דם // J. Renin-Angiotensin-Aldosterone System. 2011 כרך 12. עמ' 483-490.
25. Kelly D. J., Zhang Y., Moe G. et al. Aliskiren, מעכב רנין חדשני, מגן מחדש במודל של נפרופתיה סוכרתית מתקדמת בחולדות // Diabetol. 2007 כרך. 50. עמ' 2398-2404.
ההיסטוריה של המחקר של מערכת רנין-אנגיוטנסין-אלדוסטרון (RAAS), שהתבררה כמוצלחת ביותר מבחינת פיתוח גישות לאיפונון תרופתי של פעילותה, המאפשרת להאריך את חייהם של חולים עם מחלות לב וכליות. , התחילה לפני 110 שנה. מתי זוהה רנין - המרכיב הראשון. מאוחר יותר, במחקרים ניסויים וקליניים, ניתן היה להבהיר את תפקידו הפיזיולוגי של הרנין ומשמעותו בוויסות פעילות RAAS במצבים פתולוגיים שונים, שהפכו לבסיס לפיתוח אסטרטגיה טיפולית יעילה ביותר – מעכבי רנין ישירים.
נכון להיום, מעכב הרנין הישיר הראשון Rasilez (aliskiren) מוצדק גם במצבים בהם חוסמי RAAS אחרים - מעכבי ACE ו-ARB אינם מומלצים או השימוש בהם קשה עקב התפתחות תופעות לוואי.
נסיבות נוספות המאפשרות לסמוך על האפשרויות הנוספות של מעכבי רנין ישירים בהגנה על איברי המטרה של יתר לחץ דם בהשוואה לחוסמי RAAS אחרים, היא שכאשר משתמשים בתרופות החוסמות את ה-RAAS ברמות אחרות, על פי חוק המשוב השלילי, יש הוא עלייה בריכוז הפרונין, ועלייה בפעילות הרנין בפלזמה. נסיבות אלו הן שמבטלות את הירידה המצוינת לעתים קרובות ביעילות של מעכבי ACE, לרבות מנקודת המבט של יכולתם להפחית לחץ דם מוגבר. עוד בתחילת שנות ה-90, כאשר השפעות מגוננות אורגניות רבות של מעכבי ACE לא התבססו באופן מהימן כמו היום, הוכח שככל שהמינון שלהם עולה, פעילות הרנין בפלזמה וריכוז האנגיוטנסין בפלזמה עולים באופן משמעותי. יחד עם מעכבי ACE ו-ARBs, תיאזיד ומשתני לולאה יכולים גם לעורר עלייה בפעילות הרנין בפלזמה.
Aliskiren היה מעכב הרנין הישיר הראשון, שיעילותו אוששה בניסויים קליניים מבוקרים שלב III, בעל משך פעולה מספק ומפחית לחץ דם מוגבר אפילו במונותרפיה, וכעת ניתן לראות במרשם שלו כגישה חדשנית ל- טיפול ביתר לחץ דם. נערכו השוואות של השפעתו על ריכוז הפלזמה והפעילות של רכיבים בודדים של RAAS עם מעכבי ACE ו-ARBs. התברר שאליסקרן ואנלפריל מפחיתים כמעט באותה מידה את ריכוז הפלזמה של אנגיוטנסין II, אך בניגוד לאליסקרן, מתן אנלפריל הוביל לעלייה של יותר מפי 15 בפעילות הרנין בפלזמה. יכולתו של אלישקירן למנוע שינויים שליליים במאזן הפעילות של רכיבי RAAS הוכחה גם בהשוואה ל-ARBs.
ניתוח מאוחד של מחקר קליני שכלל סך של 8481 חולים שקיבלו אליסקירן מונותרפיה או פלצבו הראה כי מנה בודדת של אליסקירן במינון של 150 מ"ג ליום. או 300 מ"ג ליום. גרם לירידה ב-SBP ב-12.5 ו-15.2 מ"מ כספית. בהתאמה, בהשוואה להפחתה של 5.9 מ"מ כספית, פלצבו (P<0,0001). Диастолическое АД снижалось на 10,1 и 11,8 мм рт.ст. соответственно (в группе, принимавшей плацебо – на 6,2 мм рт.ст.; Р < 0,0001). Различий в антигипертензивном эффекте алискирена у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено.
בשנת 2009 פורסמו תוצאות ניסוי קליני מבוקר רב-מרכזי, בו הושוו יעילותם של אליסקירן והידרוכלורותיאזיד ב-1124 חולים עם יתר לחץ דם. במידת הצורך נוספה לתרופות אלו אמלודיפין. בסוף תקופת המונותרפיה, התברר שאלישקירן מוביל לירידה בולטת יותר בלחץ הדם מאשר הידרוכלורותיאזיד (-17.4/-12.2 מ"מ כספית לעומת -14.7/-10.3 מ"מ כספית; R< 0,001)
מעכב רנין ישיר (אליקירן)
ממריץ את הפרשת רנין על ידי הכליות, מפחית את נפח הדם במחזור הדם והזלוף של הכליה. רנין, בתורו, הופך אנגיוטנסין לאנגיוטנסין I, מבשר של אנגיוטנסין II, והאחרון מעורר מפל תגובות המוביל לעלייה בלחץ הדם. לפיכך, דיכוי הפרשת רנין יכול להפחית את ייצור האנגיוטנסין II. בזמן נטילת משתני תיאזיד, מעכבי ACE ו-ARB, פעילות הרנין בפלזמה עולה. לכן, דיכוי של פעילות רנין עשוי להיות אסטרטגיה יעילה פוטנציאלית לדיכוי מערכת הרנין-אנגיוטנסין כולה. Aliskiren היא התרופה הראשונה ממחלקה חדשה - מעכב רנין ישיר, שעבורו הוכחה פעילות של ירידה בלחץ הדם. הזמינות הביולוגית המשופרת של תכשיר הפה של אליסקרן בהשוואה לתרופות שהוצעו בעבר מהסוג הזה וזמן מחצית החיים הארוך מאפשרים ליטול תרופה זו פעם ביום.
Aliskiren מפחית ביעילות את לחץ הדם הן במונותרפיה והן בשילוב עם משתני תיאזידים (הידרוכלורותיאזיד), מעכבי ACE (רמיפריל, ליסינופריל). ARBs (valsartan) או CCBs (אמלודיפין). כאשר אליסקירן נלקח עם תרופות אלה להורדת לחץ דם, פעילות הרנין בפלזמה אינה עולה, אלא נשארת ברמה הבסיסית או אפילו מתחתיה. לאליקסירן יש בטיחות וסבילות דמויי פלצבו ואינו מקיים אינטראקציה עם מגוון רחב של תרופות, למעט פורוסמיד. כיום קיימים נתונים מוגבלים על היעילות והסבילות לטווח ארוך של אלישקירן בחולי סוכרת עם יתר לחץ דם. כתוצאה מכך, התפקיד המדויק של תרופה זו בטיפול ביתר לחץ דם בחולי סוכרת לא הוכח במלואו.
ALISKIREN (תרופה Rasilez) - טבליות 150 מ"ג ו-300 מ"ג, מינון ראשוני 150 מ"ג / פעם ביום, עם שליטה לא מספקת בלחץ הדם לאחר שבועיים, ניתן להגדיל את המינון ל-300 מ"ג / פעם ביום
מנגנון פעולה. תרופה נגד יתר לחץ דם, מעכב רנין סלקטיבי בעל מבנה שאינו פפטיד. כאשר משתמשים באלישקירן כמונותרפיה ובשילוב עם תרופות אחרות להורדת לחץ דם, דיכוי המשוב השלילי מנוטרל, וכתוצאה מכך ירידה בפעילות הרנין בפלזמה (בחולים עם יתר לחץ דם עורקי בממוצע של 50-80%), כמו גם רמות של antitensin I ו-II. לאחר המנה הראשונה, אין תגובה להורדת לחץ דם (השפעת המנה הראשונה) ועלייה רפלקסית בקצב הלב בתגובה להרחבת כלי הדם.
פרמקוקינטיקה.לאחר מתן דרך הפה, הזמן להגיע לריכוז הפלזמה המקסימלי של אליקירן הוא 1-3 שעות, הזמינות הביולוגית המוחלטת היא 2.6%. לצריכת מזון בו זמנית אין השפעה משמעותית על הפרמקודינמיקה של התרופה. לכן, ניתן ליטול אלישקירן עם או בלי אוכל. Aliskiren קשור באופן מתון לחלבוני פלזמה (47-51%), ללא קשר לריכוז. זמן מחצית החיים של אליסקרן הוא 40 שעות (משתנה בין 34 ל-41 שעות). הוא מופרש בעיקר ללא שינוי דרך המעיים (91%). כ-1.4% מהמינון הנבלע עובר חילוף חומרים בהשתתפות האיזואנזים CYP3A4. לאחר מתן פומי, כ-0.6% מהאלישקירן מופרש על ידי הכליות. בעת שימוש ב-aliskiren בחולים מעל גיל 65, התאמת מינון של התרופה אינה נדרשת. הפרמקוקינטיקה של אליסקירן אינה משתנה באופן משמעותי בחולים עם ליקוי כבד קל עד בינוני (ציון Child-Pugh 5-9).
אינטראקציה בין תרופות. ההסתברות לאינטראקציה של אליסקירן עם תרופות אחרות נמוכה.בשימוש באלישקירן עם אחת מהתרופות הבאות, ה-C max או ה-AUC שלו עשויים להשתנות: valsartan (ירידה של 28%), מטפורמין (ירידה ב-28%), אמלודיפין (עלייה של 29%), סימטידין (עלייה של 19%). מאחר שבמחקרים ניסיוניים נמצא כי P-glycoprotein (נושא קרום של מולקולות) ממלא תפקיד חשוב בוויסות הספיגה וההפצה של אליסקרן, ניתן לשנות את הפרמקוקינטיקה של האחרון בשימוש בו זמנית עם חומרים המעכבים P. -גליקופרוטאינים (תלוי במידת העיכוב). לא הייתה אינטראקציה משמעותית של אליסקירן עם מעכבים פעילים חלשים או בינוניים של P-glycoprotein, כגון atenolol, digoxin, amlodipine ו- cimetidine. עם שימוש בו-זמני עם מעכב פעיל של P-glycoprotein atorvastatin (במינון של 80 מ"ג ליום) במצב שיווי משקל, נצפתה עלייה ב-AUC ו-C max של aliskiren (מינון של 300 מ"ג ליום) ב-50%. עם מתן בו זמנית של מעכב פעיל של P-glycoprotein ketoconazole (200 מ"ג) ו- aliskiren (300 מ"ג), נצפית עלייה ב-Cmax של האחרון ב-80%. במחקרים ניסיוניים, מתן בו-זמנית של אליקירן עם ketoconazole הוביל לעלייה בספיגת האחרון ממערכת העיכול ולירידה בהפרשתו עם המרה. צפויים שינויים בריכוז הפלזמה של אלישקירן בפלזמה בעת שימוש בו-זמנית עם ketoconazole או atorvastatin בטווח הריכוזים הנקבעים על ידי הגדלת מינון ה-aliskiren פי 2. בניסויים קליניים מבוקרים, הוכחה הבטיחות של אלישקירן במינון של 600 מ"ג ועלייה במינון הטיפולי המרבי המומלץ פי 2. כאשר משתמשים ב-aliskiren יחד עם ketoconazole או atorvastatin, לא נדרשת התאמת מינון של aliskiren. בשימוש עם מעכב P-glycoprotein פעיל מאוד כמו ציקלוספורין (200 ו-600 מ"ג), אנשים בריאים הראו עלייה ב-C max וב-AUC של אליסקירן (75 מ"ג) פי 2.5 ו-5 בהתאמה (לא מומלץ להשתמש אליסקירן בו זמנית עם ציקלוספורין). בשימוש בו-זמני של aliskiren עם furosemide, יש ירידה ב-AUC וב-Cmax של furosemide ב-28% ו-49%, בהתאמה. כדי למנוע אגירת נוזלים אפשרית בעת רישום אלישקירן יחד עם פורוסמיד בתחילת הטיפול ובמהלך הטיפול, יש צורך להתאים את המינון של פורוסמיד בהתאם להשפעה הקלינית. יש לנקוט זהירות כאשר משתמשים באלישקירן במקביל עם מלחי אשלגן, תרופות משתנות חוסכות אשלגן, תחליפי מלח שולחן המכילים אשלגן, או כל מוצר תרופתי אחר שיכול להגביר את ריכוז האשלגן בדם.
תופעות לוואי.ממערכת העיכול: לעיתים קרובות - שלשולים. תגובות דרמטולוגיות: לפעמים - פריחה בעור. מהצד של פרמטרי מעבדה: לעיתים רחוקות - ירידה קלה בריכוז ההמוגלובין וההמטוקריט (בממוצע ב-0.05 ממול/ליטר ו-0.16% בהתאמה), שלא הצריכה הפסקת טיפול, עלייה קלה בריכוז האשלגן בסרום הדם (0.9% לעומת 0.6% עם פלצבו). תגובות אלרגיות: במקרים מסוימים - אנגיואדמה.
התוויות נגד והגבלות.התוויות נגד: ילדים ומתבגרים מתחת לגיל 18 שנים, הריון, הנקה (הנקה), רגישות יתר לאליסקרן. השימוש במהלך ההריון וההנקה (הנקה) הוא התווית נגד.
היעילות והבטיחות של אלישקירן לא הוכחו בחולים עם ליקוי כבד חמור (יותר מ-9 נקודות בסולם Child-Pugh).
היעילות והבטיחות של אלישקירן לא הוכחו: בחולים עם תפקוד כליות לקוי חמור (קריאטינין בסרום מעל 150 מיקרומול/ליטר לנשים ו->177 מיקרומול/ליטר לגברים ו/או קצב סינון גלומרולרי נמוך מ-30 מ"ל לדקה), עם תסמונת נפרוטית, יתר לחץ דם renovascular ובמהלך הליך המודיאליזה רגיל.
בזהירות, יש להשתמש באליסיקירן בחולים עם היצרות בעורק הכליה חד-צדדי או דו-צדדי או היצרות של עורק של כליה בודדת, סוכרת, מופחתת BCC, היפונתרמיה, היפרקלמיה או חולים לאחר השתלת כליה.
היעילות והבטיחות של אלישקירן לא הוכחו: בחולים עם תפקוד כליות לקוי חמור (קריאטינין בסרום מעל 150 מיקרומול/ליטר לנשים ו->177 מיקרומול/ליטר לגברים ו/או קצב סינון גלומרולרי נמוך מ-30 מ"ל לדקה), עם תסמונת נפרוטית, יתר לחץ דם renovascular ובמהלך הליך המודיאליזה רגיל, וכן בחולים עם הפרעה חמורה בתפקוד הכבד (יותר מ-9 נקודות בסולם Child-Pugh), בחולים עם היצרות חד-צדדית או דו-צדדית של עורקי הכליה או היצרות של העורקים הכלייתיים. עורק של כליה בודדת.
בחולים עם סוכרת במהלך טיפול באלישקירן בשילוב עם מעכב ACE, חלה עלייה בתדירות ההיפרקלמיה (5.5%). בעת שימוש באלישקירן ותרופות אחרות המשפיעות על RAAS בחולי סוכרת, יש צורך לעקוב באופן קבוע אחר הרכב האלקטרוליטים של פלזמת הדם ותפקוד הכליות.
על רקע הטיפול באלישקירן תיתכן עלייה בריכוז האשלגן, הקריאטינין והחנקן של אוריאה בדם, האופיינית לתרופות המשפיעות על ה-RAAS. בתחילת הטיפול באלישקירן בחולים עם BCC מופחת ו/או היפונתרמיה (כולל על רקע מינונים גבוהים של משתנים), תת לחץ דם עורקי סימפטומטי אפשרי. לפני השימוש, יש לבצע תיקון של הפרות של מאזן מים-מלח. בחולים עם BCC מופחת ו/או היפונתרמיה, הטיפול צריך להתבצע תחת השגחה רפואית צמודה.
מערכת רנין-אנגיוטנסין-אלדוסטרון ממלאת תפקיד מפתח בוויסות לחץ הדם ומאזן הנוזלים והאלקטרוליטים. מעכב ישיר של רנין - אלישקירן, על ידי הפחתת הפעילות של רנין פלזמה, הוא בעל השפעות קרדיו-ונפרוטקטיביות. ההשפעה נגד יתר לחץ דם אינה תלויה במין, גזע, גיל, מדד מסת הגוף. ההשפעה נגד יתר לחץ דם של אלישקירן ומעכבי האנזים הממירים אנגיוטנסין, חוסמי קולטן אנגיוטנסין II ואנטגוניסטים לסידן דומה. Aliskiren יעיל בחולים עם השמנת יתר, סוכרת, תפקוד כליות לקוי ותסמונת מטבולית.
מעכבי רנין ישירים - אליקירן בטיפול ביתר לחץ דם עורקי
מערכת רנין-אנגיוטנסין-אלדוסטרון ממלאת תפקיד מפתח בוויסות לחץ הדם ומאזן הנוזלים והאלקטרוליטים. מעכב רנין ישיר - אליסקירן, הפחתת פעילות רנין בפלזמה, מספק השפעות הגנה על לב וכלי דם. השפעה נגד יתר לחץ דם אינה תלויה במין, גזע, גיל, אינדקס מסת הגוף. ההשפעה נגד יתר לחץ דם של אליסקירן ומעכבי האנזים הממירים אנגיוטנסין, חוסמי קולטן אנגיוטנסין II, אנטגוניסטים לסידן דומה. Aliskiren יעיל בחולים עם השמנת יתר, סוכרת, הפרעות בתפקוד הכליות ותסמונת מטבולית.
במהלך לימוד מערכת רנין-אנגיוטנסין-אלדוסטרון (RAAS), פותחו גישות לוויסות פעילותה הפרמקולוגית. המרכיב הראשון של ה-RAAS, רנין, זוהה לפני 110 שנה. מאוחר יותר הוכחה חשיבותה בוויסות פעילות RAAS במצבים פתולוגיים, שהפכה לבסיס להתפתחות מעכבי רנין ישירים (DRI). ה-RAAS ממלא תפקיד מפתח בוויסות לחץ הדם (BP) ומאזן הנוזלים והאלקטרוליטים. לעלייה בפעילות RAAS יש תפקיד חשוב בהיווצרות והתקדמות של יתר לחץ דם עורקי (AH), אי ספיקת לב כרונית (CHF), מחלת כליות כרונית וטרשת עורקים מערכתית. RAAS מעורב ישירות בתהליכי צמיחת רקמות והתמיינות, אפנון דלקת ואפופטוזיס, כמו גם הגברת הסינתזה וההפרשה של מספר חומרים נוירו-הומורליים. ההשפעות העיקריות של RAAS מתממשות באמצעות אנגיוטנסין II (ATII) באמצעות גירוי של קולטנים ספציפיים. הפעלה של תת-סוג קולטן אנגיוטנסין (AT1) מובילה לכיווץ כלי דם, מעוררת שחרור של וזופרסין, אלדוסטרון, אנדותלין, נוראדרנלין. התפקיד הפיזיולוגי של תת-סוגים אחרים של קולטני אנגיוטנסין (AT3, AT4 ו-ATx) ממשיך להיחקר. ATII תורם להצטברות מטריצת קולגן, ייצור ציטוקינים, מולקולות דביקות, הפעלת מערכת האיתות התוך תאית, ביטוי מוגבר של גנים פנוטיפ עובריים, ממלא תפקיד חשוב בשיפוץ שריר הלב והיפרטרופיה של חדר שמאל (LV), ATII משתתף בתהליכים של שיפוץ עורקים, העצמת עקה חמצונית ואפופטוזיס, תורם להיווצרות ולהתקדמות של יתר לחץ דם, CHF, נזק לכלי דם טרשת עורקים, נפרופתיה סוכרתית ולא סוכרתית, אנגיופתיה בסוכרת (DM), אקלמפסיה של נשים בהריון, מחלת אלצהיימר. ההתקדמות של מחלות לב וכלי דם אינה תלויה באפקט כלי הדם של ATII.
הפרשת רנין היא הצעד הראשון בהגברת הסינתזה של ATI, ATII ומוצרים אחרים של מפל ה-RAAS. היישום של ההשפעות הבאות של RAAS מווסת על ידי השפעת רנין על קולטנים ספציפיים, מה שגורם לעלייה ב-ATII.
עד לאחרונה, היו קיימים מעכבי RAAS הבאים - מעכבי אנזים הממיר אנגיוטנסין (מעכבי ACE) וחוסמי קולטן ATII (ARB). מנגנון הפעולה של מעכבי ACE הוא כדלקמן: פעילות ACE מדוכאת, מה שמוביל לירידה בהשפעות של ATII ולהאטה בפירוק כלי הדם (ברדיקינין ופרוסטגלנדין E 2). ARBs מעכבים באופן תחרותי את קולטני ATII ומפחיתים את ההשפעות של ATII. הקולטנים לרנין ופרונין ממוקמים על פני התא. הפעלת מסלול האיתות הסלולרי על ידי רנין מובילה לפיברוזיס והיפרטרופיה תאית. בשנים האחרונות נשלטת פעילות RAAS על ידי הגבלת ייצור ATII, חסימה של קולטני ATII ואלדוסטרון, עקב הגבלת הפרשת רנין, בעיקר באמצעות שימוש בחוסמי β. מחקרים רבים הראו כי ירידה נאותה בפעילות RAAS בעזרת מעכבי ACE, ARBs או אלדוסטרון מונחת ולא מושגת, שכן תופעת ה"בריחה" של ההשפעות נגד יתר לחץ דם ואורגניות של חוסמי RAAS מתפתחת במהלך טווח הארוך שלהם. להשתמש. כדי להתגבר על תופעה זו משתמשים בשילובים של מעכב ACE + ARB, מעכב ACE + חוסם β, מעכב ACE + ספירונולקטון. הופעתו של PIR נתפסת כדרך להשיג שליטה מלאה יותר בפעילות RAAS ולהתגבר על תופעת ה"בריחה".
ה-PIR הראשונים יוצרו בשנות ה-70, אך התרופה הראשונה המתאימה למתן דרך הפה הייתה אליסקירן (A). א', על ידי קישור לחלק הפעיל של מולקולת המטרה, מונע את האינטראקציה שלה עם אנגיוטנינוגן. על ידי הפחתת הפעילות של רנין פלזמה (ARP), ל-A. יש השפעות קרדיו-ונפרוטקטיביות. מעכבי RAAS מעוררים ARP, וכתוצאה מכך ההשפעות הבאות: כיווץ כלי דם בגלומרולוס, דלקת, פיברוזיס (כליות); היפרטרופיה, פיברוזיס, כיווץ כלי דם (לב); היפרפלזיה, היפרטרופיה, דלקת, חמצון שומנים, פיברוזיס (כלים); כיווץ כלי דם (מוח). א' פועל בנקודת ההפעלה של ה-RAAS ומפחית את ה-ARP. שלא כמו מעכבי ACE ו-ARBs, A מפחית את רמות ATI, AII ו-ARP. לרנין פעילות אנזימטית כמו גם מתווכת קולטן.
פרמקוקינטיקה א. מחקרים קליניים הראו סבילות דומה לפלצבו. משך הפעולה של תרופה זו עולה על 24 שעות, והרחבת כלי הדם הכלייתיים עלולה להימשך עד 48 שעות. זמן מחצית החיים של A הוא כ-40 שעות, מה שמספק מנה בודדת ליום. מינון ההתחלה המומלץ A הוא 150 מ"ג עם עליה נוספת ל-300 מ"ג. מאפיינים פרמקוקינטיים של A אינם תלויים בגליקמיה בצום ובריכוזים של המוגלובין מסוכר בפלזמה. חיסול התרופה מתבצע ללא שינוי במרה, הפרשה בשתן היא<1%. Исследования первой и второй фазы показали, что препарат способствует эффективной блокаде РААС и дозозависимому предотвращению повышения уровня АД . Полный антигипертензивный эффект наступает через 2 недели и не зависит от пола, расы, возраста, индекса массы тела. А обладает минимальным риском лекарственных взаимодействий, не требует коррекции дозы при хронической почечной недостаточности (ХПН), при поражении печени. Добавление А к ловастатину, атенололу, варфарину, фуросемиду, дигоксину, целекоксибу, гидрохлоротиазиду (ГХТЗ), рамиприлу, валсартану, метформину и амлодипину не приводило к клинически значимому увеличению экспозиции А. Совместное его применение с аторвастатином приводило к 50% увеличению Cmax (максимальная концентрацию препарата) и AUC (площадь под кривой «концентрация - время») после приема нескольких доз. Совместное применение 200 мг кетоконазола 2 раза в день с А приводило к 80% увеличению уровня А в плазме. При совместном применении А с фуросемидом AUC и Cmax фуросемида снижались на 30 и 50% соответственно . Не требуется коррекции дозы А у пациентов с ХПН. У пациентов с ХПН отмечается умеренное (~двухкратное) увеличение экспозиции А, но оно не коррелировало с тяжестью поражения почек и клиренсом креатинина. Клиренс А составлял 60–70 % у здоровых. Почечный клиренс А уменьшался с увеличением тяжести поражения почек. Поскольку поражение почек оказывает только умеренное влияние на экспозицию А, то коррекция дозы А, скорее всего, не требуется у пациентов с гипертензией и поражением почек. Не требуется коррекции дозы А и у пациентов поражением печени. Не было отмечено достоверной корреляции между экспозицией А и тяжестью поражения печени. А способен осуществлять блокаду РААС, что приводит к снижению сосудистого тонуса и системного АД. Однако препарат не лишен и негативных качеств, связанных с феноменом «ускользания», что характерно для всех лекарственных средств, блокирующих активность РААС. Снижение эффективности А вследствие восстановления секреции ренина или наличия синдрома отмены не подтверждается клиническими наблюдениями .
יעילות להורדת לחץ דם א. ARP הוא אינדיקטור הכרחי לא רק לאבחון של צורות משניות נדירות של יתר לחץ דם (renovascular). המשמעות הקלינית והפרוגנוסטית של ARP היא כדלקמן: האינדיקטור עולה עם יתר לחץ דם בשילוב עם גורמי סיכון אחרים (מין גברי, עישון, סוכרת מסוג 2, השמנת יתר (Ob.), תסמונת מטבולית) ובנוכחות נזק לאיברי המטרה ( TOM) (ירידה מתמשכת בקצב הסינון הגלומרולרי); עלייה ב-ARP של רנין יכולה להיות אטרוגנית, מעוררת על ידי מעכבי ACE ו/או משתנים (לולאה, תיאזיד), ולגרום לאובדן נתרן כלייתי: נצפית הפעלה נוספת של ה-RAAS, מה שמוביל לאובדן שליטה על לחץ הדם ולהתקדמות של CHF; עלייה ב-ARP תמיד נוטה להחמרה של POM ולסיבוכים קרדיווסקולריים פוטנציאליים (CV) וכליות; ARP מוגבר הוא גורם בלתי תלוי להשפעה הפרמקולוגית של PIR, המאפשרת להשיג ירידה בלחץ הדם ועיכוב התקדמות POM. א' יכולה לתבוע את תפקידה של תרופה יעילה להורדת לחץ דם במונותרפיה ובשילוב עם תרופות אחרות. אינדיקציות לשימוש ב-PIR הן: גרסאות היפרנין של יתר לחץ דם, יתר לחץ דם נומורנין, בהן פרונין והפעלה מתווכת של קולטני פרונין מובילים להרס רקמות. PIR מיועד לא רק עבור יתר לחץ דם renovascular ו-CHF, אלא גם עבור ריכוז פלזמה מוגבר של prorenin (יתר לחץ דם עם היפראקטיבציה של מערכת העצבים הסימפתטית, תסמונת מטבולית, סוכרת מסוג 2, גיל המעבר).
מונותרפיה א' מספקת הפחתה תלוית מינון בלחץ הדם הדיאסטולי (DBP) ובלחץ הדם הסיסטולי (SBP) בחולים עם יתר לחץ דם קל עד בינוני. הערכת היעילות והבטיחות של A. ב-672 חולים עם יתר לחץ דם בדרגות I-II (st.) במחקר מבוקר פלצבו של 8 שבועות גילתה ירידה תלוית מינון ב-SBP ו-DBP. ההשפעה נגד יתר לחץ דם של A נמשכה שבועיים לאחר הפסקת התרופה; A נסבל היטב; תדירות תופעות הלוואי לא הייתה שונה מפלסבו. A - שם מסחרי rasilez (P) - במינון של 150 מ"ג מפחית את ה-SBP ב-13 מ"מ כספית. Art., ו-DBP ב-10.3 מ"מ כספית. Art., ובמינון של 300 מ"ג מפחית את ה-SBP מ-15 ל-22 מ"מ כספית. אומנות. (בהתאם לאמנות. AG), ו-DBP - ב-11 מ"מ כספית. אומנות. A מספקת שליטה על לחץ הדם בשעות הבוקר המוקדמות. לאחר ביטול א' אין תופעת "ריבאונד". ניתוח מאוחד של ניסויים קליניים כולל 8481 חולים. שטופלו במונותרפיה A או פלצבו, הראו כי מנה בודדת של A במינון של 150 או 300 מ"ג ליום גרמה לירידה ב-SBP ב-12.5 ו-15.2 מ"מ כספית. אומנות. בהתאמה, בהשוואה לירידה של 5.9 מ"מ כספית. אומנות. בחולים המקבלים פלצבו (עמ'<0,0001). ДАД снижалось на 10,1 (на дозе 150 мг) и 11,8 мм рт. ст. (на дозе 300 мг) соответственно (в группе плацебо - на 6,2 мм рт. ст., р<0,0001). Различий в антигипертензивном эффекте А у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено. При применении иАПФ увеличиваются концентрации проренина и АРП (снижается эффективность иАПФ). При увеличении дозы иАПФ достоверно нарастает АРП и плазменная концентрация АТI . Исследование А в сравнении с иАПФ у пациентов с мягкой и умеренной АГ установило следующее: А достоверно больше снижает ДАД и САД, чем рамиприл через 12 недель лечения (монотерапия). А ± гидрохлортиазид (ГХТЗ) достоверно больше снижает ДАД и САД, чем рамиприл ± ГХТЗ через 26 недель лечения. А достоверно больше снижает ДАД и САД, чем рамиприл через 12 недель лечения (монотерапия) у пациентов с АГ II ст. Терапия А обеспечивает достоверно лучший контроль АД по сравнению с рамиприлом. САД и ДАД возвращаются к исходному уровню более быстро после отмены рамиприла, чем после отмены А. Сравнение гипотензивной эффективности А, ирбесартана и рамиприла после пропущенной дозы показало следующее: после пропущенной дозы достигнутое снижение АД было достоверно больше в группе А., чем в группе рамиприла . Достоверно больший процент снижения АД поддерживается после пропущенной дозы А по сравнению с ирбесартаном или рамиприлом. Возвращение к исходному АД происходит более плавно после отмены А., чем рамиприла. А. и эналаприл почти в равной степени уменьшают плазменную концентрацию АТП, но в отличие от А прием эналаприла приводил к более чем 15-кратному росту АРП. В условиях низкосолевой диеты индуцированная А органная (в частности, почечная) вазодилатация может сохраняться до 48 часов. Провоцировать подъем АРП могут препараты, стимулирующие натрийурез (тиазидовые и петлевые диуретики). Назначение А. в этой ситуации один из наиболее действенных подходов к устранению реактивного повышения АРП при комбинации с иАПФ и тиазидовым диуретиком.
בשנת 2009 פורסמו תוצאות ניסוי קליני מבוקר רב-מרכזי, שבו הושוו היעילות של A ו-HCTZ (טיפול ראשוני נגד יתר לחץ דם) ב-1124 חולים עם יתר לחץ דם; במידת הצורך, נוספה אמלודיפין לתרופות אלו. בסוף תקופת המונותרפיה (שבוע 12), התברר ש-A מוביל לירידה בולטת יותר בלחץ הדם מאשר HCTZ (-17.4/-12.2 מ"מ כספית לעומת -14.7/-10.3 מ"מ כספית, r<0,001). Эти результаты важны, поскольку большинство пациентов, страдающих АГ, исходно нуждаются в комбинированной антигипертензивной терапии. Оптимизация комбинированной антигипертензивной терапии важна у пациентов с Ож. при этом у А имеются дополнительные преимущества . Больные с Ож, у которых полная (25 мг/сут) доза ГХТЗ не приводила к снижению АД, были рандомизированы на группы, которым назначали амлодипин + ГХТЗ (10/25 мг/сут), ирбесартан + ГХТЗ (300/25 мг/сут) и А. + ГХТЗ (300/25 мг/сут). По мере нарастания ст. Ож антигипертензивная эффективность схем лечения (БРА + ГХТЗ, антагонист кальция + ГХТЗ) снижается. В группе с Ож. III ст. (ИМТ≥40 кг/м 2) только у 50% удалось достичь целевого АД с помощью ирбесартана + ГХТЗ, у 43,8% - с помощью амлодипина + ГХТЗ и лишь у 16,7% - с помощью ГХТЗ. При менее выраженном (I–II ст.) Ож более чем у 40% пациентов, получавших БРА + ГХТЗ или амлодипин + ГХТЗ, и более чем у 60% больных, принимавших только ГХТЗ, целевое АД не было достигнуто. В группе пациентов с Ож. I-II ст., получавших А. + ГХТЗ, целевого АД достигли 56,7% больных, а с Ож. III ст. - 68,8%. АГ, сочетающаяся с Ож, часто ассоциируется с увеличением активности РААС и трудно корригируется, поэтому в таких случаях может быть назначен А.
הוכחה יכולתו של א' להפחית לחץ דם ולהפחית אלבומינוריה. במחקר AVOID בקרב 599 חולים עם נפרופתיה סוכרתית עם יתר לחץ דם, הוערכה ההשפעה של השילוב של המינונים המרביים של losartan ו-A על אלבומינוריה (ביחס בין אלבומין/שתן קריאטינין). התוספת של A (300 מ"ג ליום) ללוסארטן (100 מ"ג ליום) לוותה בירידה משמעותית ביחס אלבומין/קריאטינין בשתן ב-20% בקבוצה כולה (100%), וב-24.7% על ידי 50% או יותר. בקבוצת הלוסרטן + פלצבו, הושגה ירידה ביחס אלבומין/קריאטינין בשתן של 50% או יותר רק ב-12.5% מהחולים (p<0,001). ПИР могут уменьшить альбуминурию как в режиме монотерапии, так и при комбинации с БРА, позволяющей достичь оптимальной ст. блокады РААС, обеспечивающей устранение генерализованной и локально-почечной дисфункции эндотелия.
ועם טיפול משולב של יתר לחץ דם.בחולים עם יתר לחץ דם קל עד בינוני ללא ועם A. + HCTZ מספקים הפחתה משמעותית ב-DBP ו-SBP. יותר חולים משיגים שליטה בלחץ הדם עם שילוב A + HCTZ מאשר עם שילובים אחרים של HCTZ. בחולים עם יתר לחץ דם ו-DM, A + ramipril מפחית בצורה משמעותית את לחץ הדם מאשר שני מרכיבי המונותרפיה. A מספק בקרת לחץ דם טובה יותר באופן משמעותי מאשר ramipril. בחולים עם יתר לחץ דם קל עד בינוני, A + valsartan מוריד את לחץ הדם בצורה משמעותית יותר משני מרכיבי המונותרפיה. A מפחית משמעותית את לחץ הדם בשילוב עם אמלודיפין במינון של 5 מ"ג ליום. A מעלה את רמת בקרת לחץ הדם בהשוואה לאמלודיפין במינון של 5 מ"ג ליום. A. ± HCTZ יעילים בטיפול ארוך טווח של יתר לחץ דם. A + valsartan ± HCTZ מספקים יעילות ארוכת טווח להורדת לחץ דם (ניתוח ביניים של 6 חודשי טיפול).
בשנת 2009 פורסם התכנון של מחקר ALTITUDE (ניסוי אליקירן בסוכרת מסוג 2 באמצעות נקודות קצה קרדיו-כליות) (חלק מתכנית ASPIRE HIGHER), החוקר את השפעת החסימה הכפולה של ה-RAAS תוך שימוש בשילוב של A וסטנדרטי. טיפול (מעכב ACE או ARB) בחולים עם סוכרת מסוג 2 עם סיכון גבוה ל-CVC וסיבוכי כליות, בין היתר בשל העלייה ב-RDA. המטרה העיקרית של מחקר זה היא להעריך את היעילות של הוספת A לטיפול הסטנדרטי על ההשפעה על נקודת הסיום המשולבת (מוות קרדיווסקולרי וסיבוכים: החייאה מוצלחת, MI לא קטלני, שבץ מוחי לא קטלני, אשפוז לא מתוכנן עקב CHF; התפתחות של אי ספיקת כליות סופנית, הכפלת קריאטינין בסרום, מוות מסיבות הקשורות לנזק לכליות). מחקר זה אמור להימשך כ-4 שנים, ותוצאותיו נועדו להצדיק שימוש בשילוב של A. עם מעכב ACE או ARB כדי לעכב את התקדמות התסמונת הקרדיונראלית בסוכרת מסוג 2. ניתן לצפות ליעילות הגבוהה ביותר של A באותם וריאנטים של יתר לחץ דם, בהם יש נטייה להגביר ARP (יתר לחץ דם מתעורר, obj., תסמונת מטבולית, סוכרת מסוג 2, אי ספיקת כליות כרונית). הרוב המוחלט של החולים עם יתר לחץ דם כבר בשלב הראשון של הטיפול דורשים טיפול משולב נגד יתר לחץ דם וכפי שהוצג באחד הניסויים הקליניים שפורסמו לאחרונה, כחלק משילובים, A שומרת על פעילותה ללא קשר ל-ARP הראשוני. העלייה ב-ARP בחולים עם יתר לחץ דם נחשבת כסמן אבחנתי וכגורם סיכון בלתי תלוי לאירועי CV שעלולים להיות קטלניים. אפנון תרופתי של ARP הוא אחת הגישות המבטיחות ביותר לניהול הסיכון ל-CVD בחולים עם AH הקשורים לנזק לכליות, לתסמונת מטבולית והשמנת יתר. . מחקר AVOID (Aliskiren in the eValuation of proteinuria In Diabetes) (חלק מתוכנית ASPIRE HIGHER) נועד להעריך את הפוטנציאל של תרופה מסוימת להורדת לחץ דם בהגנה על איברי מטרה במגוון מצבים המאופיינים בסיכון גבוה מאוד לקטלני סיבוכים (היפרטרופיה LV, סוג 2 DM). , HSN). תוצאות ביניים מצביעות על כך שחסימת A ישירה של רנין היא אחת האסטרטגיות הזמינות ביותר לשיפור הפרוגנוזה לטווח ארוך. במחקר ALLAY (The Aliskiren Left Ventricular Assessment of Hypertrophy), A גרם לירידה במדד המסה של שריר הלב LV, המשקפת את נסיגה של ההיפרטרופיה שלו, בחולים עם יתר לחץ דם ועודף משקל. השילוב של A ולוזארטן סיפק ירידה נוספת במדד המסה של שריר הלב LV ב-20% נוספים בהשוואה ללוסארטן בלבד, אך הבדל זה לא הגיע לערך מובהק סטטיסטית. על פי תוצאות מחקר ALOFT (מחקר ALiskiren Observation of Heart Failure Treatment), הוספה של A למשטר הטיפול הסטנדרטי עבור CHF עם סימנים של פרוגנוזה לקויה (עלייה מתמשכת בריכוז הפלזמה של פפטיד נטריאורטי) ויתר לחץ דם שיפרו עוד יותר את היחס בגודל של רגורגיטציה מיטרלי לאזור הפתח המיטרלי וזרימת הדם הטרנסמיטרלית. הודות ל-A, ניתן היה להשיג ירידה בריכוז הסמנים של הפעלה נוירו-הומורלית לא מסתגלת (רמות פלזמה של פפטיד נטרי-אורטי במוח ומבשר N-aminoterminal שלו (NT-pro BNP), ריכוז אלדוסטרון בשתן, ARP). הסיכויים לשימוש ב-A למטרת עיכוב התפתחות של נזק לכליות נקבעים על ידי בטיחותו הגבוהה, העולה ללא ספק על חוסמי RAAS אחרים (מעכבי ACE, ARBs ואנטגוניסטים אלדוסטרון) בשל סיכון נמוך יותר להגברת קריאטינינמיה ואשלגן. מופרש בעיקר במרה ולא בשתן, A שומר על השפעתו נגד יתר לחץ דם אך אינו פוגע בתפקוד הכלייתי בחולים עם ירידה מתמשכת בקצב הסינון הגלומרולרי. בתחום הנפרולוגיה חסימה אגרסיבית של RAAS בעזרת מספר סוגים של תרופות המשמשות בו זמנית יכולה להיות יעילה במונחים של מניעת אי ספיקת כליות סופנית. A מפחית את האלבומינוריה (עדיפה משמעותית על מונותרפיה עם כל אחת מהתרופות) ואת הסבירות להידרדרות בלתי הפיכה בתפקוד הכליות בקבוצת חולים (עם פרוטאינוריה> 1 גרם ליום), כפי שהוצג במחקר COOPERATE (טיפול משולב של אנגיוטנסין -II חוסם רצפטורים ומעכבי אנזים הממיר אנגיוטנסין במחלת כליות שאינה סוכרתית). מחקר ONTARGET (OngoiNg Telmisartan Alone ובשילוב עם Ramipril Global Endpoint Trial) הראה שהשילוב של מעכבי ACE ו-ARB קשור בסבירות גבוהה יותר ליתר לחץ דם עורקי והיפרקלמיה, ובהשוואה למונותרפיה עם תרופות אלו, קשור ל- עלייה בתדירות התחלת ההמודיאליזה בתוכנית והכפלה של קריאטינימיה בחולים בסיכון גבוה עם POM. האובייקטים של הדגמה של תכונות הגנה על הכליות של A. עשויים להיות המצבים הקליניים הבאים: יתר לחץ דם / תסמונת מטבולית או סוכרת מסוג 2 עם אלבומינוריה; AH קשור לירידה מתמשכת בקצב הסינון הגלומרולרי; יתר לחץ דם במחלת כליות כרונית עם פרוטאינוריה (כולל נפרוטית) ובלעדיה (לדוגמה, נפרופתיה tubulo-interstitial); יתר לחץ דם renovascular ממקורות שונים; חולים שמסיבות שונות יש להם עלייה בקריאטינימיה או היפרקלמיה בעת שימוש במעכבי ACE או ARBs; אי ספיקת כליות כרונית סופנית, לרבות אלה שטופלו בהמודיאליזה תוכנית או דיאליזה צפקית חוץ קבועה; מושתלי כליה.
סוג חדש של תרופות להורדת לחץ דם (איידס) דורש מחקר נוסף כדי להגדיל את כמות הראיות להאטת התקדמות POM.
A, כמובן, מסומן עבור רוב הקטגוריות של חולים הסובלים מיתר לחץ דם, ומצב זה בא לידי ביטוי בהמלצות הרוסיות על יתר לחץ דם לאבחון וטיפול ביתר לחץ דם (עדכון רביעי, 2010) כקבוצה נוספת של תרופות להורדת לחץ דם לטיפול משולב. עם התפתחות של נזק לכליות, A עשוי להיות יעיל במניעת אי ספיקת כליות סופנית ובשיפור הפרוגנוזה של חולים אלו.
על. אנדרייצ'ב, ז.מ. גלייבה
האוניברסיטה לרפואה של מדינת קאזאן
אנדרייצ'ב נייל אלכסנדרוביץ' - מועמד למדעי הרפואה, פרופסור חבר, המחלקה לפקולטה לטיפול וקרדיולוגיה
סִפְרוּת:
1. Bauer J.H., Reams G.P. אנטגוניסטים לקולטן אנגיוטנסין II סוג 1. סוג חדש של תרופות להורדת לחץ דם // Arch. מתמחה. Med. - 1995. - כרך. 155(13). - ר' 1361-1368.
2. Kim S., Iwao H. מנגנונים מולקולריים ותאיים של מחלות לב וכליות בתיווך אנגיוטנסין II // Pharmacol. לְהַאִיץ. - 2000. - כרך. 52(1). - ר' 11-34.
3. בראון M. J. Aliskiren // Circulation. - 2008. - כרך. 118(7). - ר' 773-784.
4. Nguyen G., Delarue F., Burckle C. et al. תפקיד מרכזי של קולטן רנין/פרורין בייצור אנגיוטנסין II ובתגובות התא לרנין // Clin. להשקיע. - 2002. - כרך. 109(11). - ר' 1417-1427.
5. Nussberger J., Wuerzner G., Jensen C. et al. דיכוי אנגיוטנסין II בבני אדם על ידי מעכב רנין פעיל דרך הפה Aliskiren (SPP100): השוואה לאנלפריל // יתר לחץ דם. - 2002. - כרך. 39(1). - ר' 1-8.
6. Zhao C., Vaidyanathan S., Dieterich H. A. et al. הערכת האינטראקציה הפרמקוקינטית בין מעכב הרנין הישיר דרך הפה aliskiren ו-furosemide: מחקר במתנדבים בריאים // Clin. פרמקול. ת'ר. - 2007. - כרך. 81 (ספק 1). - ש' 110 (PIII-78).
7. Gradman A.H., Kad R. Renin inhibition in hypertension // Am. קול. cardiol. - 2008. - כרך. 51(5). - ש' 519-528.
8. Oh B.-H., Mitchell J., Herron J.R. et al. Aliskiren, מעכב רנין דרך הפה, מספק יעילות תלוית מינון ובקרת לחץ דם מתמשכת 24 שעות ביממה בחולים עם יתר לחץ דם // Am. קול. cardiol. - 2007. - כרך. 49. - ש' 1157-1163.
9. פישר N.D., Jan Danser A.H., Nussberger J. et al. תגובות כליות והורמונליות לעיכוב ישיר של רנין עם אליסקירן באדם בריא // מחזור הדם. - 2008. - כרך. 117 (25). - ש' 3199-3205.
10. Dahlo F.B., Anderson D.R., Arora V. et al. Aliskiren, מעכב רנין ישיר, מספק יעילות להורדת לחץ דם וסבילות מצוינת ללא תלות בגיל או מין בחולים עם יתר לחץ דם (abstr) // Clin. לַחַץ יֶתֶר. - 2007. - כרך. 9 (מוסף א'). - S.A157.
11. Andersen K., Weinberger M.H., Egan B. et al. יעילות ובטיחות השוואתית של אליסקירן, מעכב רנין ישיר דרך הפה, ורמיפריל ליתר לחץ דם: ניסוי אקראי כפול סמיות בן 6 חודשים // יתר לחץ דם. - 2008. - כרך. 26. - ש' 589-599.
12. Schmieder R.E., Philipp T., Guerediaga J. et al. יעילות ובטיחות להורדת לחץ דם לטווח ארוך של מעכב רנין ישיר דרך הפה אליקירן. ניסוי השוואה כפול סמיות אקראי בן 12 חודשים עם הידרוקורטיאזיד // מחזור. - 2009. - כרך. 119. - ש' 417-425.
13. Prescott M.F., Boye S.W., Le Breton S. et al. יעילות להורדת לחץ דם של מעכב רנין ישיר אליסקירן בתוספת לטיפול בהידרוכלורותיאזיד בחולים עם השמנה קיצונית ויתר לחץ דם // Am. קול. cardiol. - 2007. - כרך. 49 (9, תוספת א'). - ש' 370א. - (עמ' 1014-169).
14. Persson F., Rossing P., Schjoedl K.J. et al. מהלך הזמן של ההשפעות האנטי-פרוטאינוריות והנוגדות יתר לחץ דם של עיכוב רנין ישיר בסוכרת מסוג 2 // Kidney Int. - 2008. - כרך. 73(12). - ש' 1419-1425.
15. Parving H.H., Persson F., Lewis J.B. et al. הימנע מחוקרי מחקר. Aliskiren בשילוב עם losartan בסוכרת מסוג 2 ונפרופתיה // N. Engl. J. Med. - 2008. - כרך. 358 (23). - ש' 2433-2446.
16. Jordan J., Engli S., Boye S.W. et al. עיכוב ישיר של רנין עם אלישקירן בחולים שמנים עם יתר לחץ דם עורקי // יתר לחץ דם. - 2007. - כרך. 49. - ש' 1-9.
17. Uresin Y., Taylor A., Kilo C. et al. יעילות ובטיחות של מעכב רנין ישיר אליסקירן ורמיפריל לבד או בשילוב בחולים עם סוכרת ויתר לחץ דם // רנין. אנגיוטנסין אלדוסטרון סיסט. - 2007. - כרך. 8. - ש' 190-198.
18. Oparil S., Yarrows S., Patel S. et al. יעילות ובטיחות של שימוש משולב ב- aliskiren ו- valsartan בחולים עם יתר לחץ דם: ניסוי אקראי, כפול סמיות // Lancet. - 2007. - כרך. 370. - ש' 221-229.
19. Drummond W., Munger M.A., Essop M.R. et al. יעילות נגד יתר לחץ דם של מעכב רנין פומי ישיר אליסקירן כטיפול נוסף בחולים שאינם מגיבים למונותרפיה אמלודיפין // Clin. לַחַץ יֶתֶר. - 2007. - כרך. 9. - ש' 742-750.
20. Chrysant S.G., Murray A.V., Hoppe U.C. et al. בטיחות, סבילות ויעילות לטווח ארוך של אליסקירן בשילוב עם ולסרטן בחולים עם יתר לחץ דם: ניתוח ביניים של 6 חודשים // Curr. Med. מילון דעה. - 2008. - כרך. 24(4). - ש' 1039-1047.
21. ניסוי אליסקירן בסוכרת מסוג 2 באמצעות נקודות קצה קרדיו-כליות (ALTITUDE): רציונל ותכנון מחקר // השתלת חוגה של Nephrol. - 2009. - כרך. 24(5). - ש' 1663-1671.
22. Stanton A.V., Dicker P., O'Brien E.T. מונותרפיה ב-Aliskiren מביאה להורדת לחץ הדם הגדולה והמועטה ביותר בחולים עם רמות PRA גבוהות ונמוכות, בהתאמה // Am. י. יתר לחץ דם. - 2009. - כרך. 22. - ש' 954-957.
23. Mukhin N. A., Fomin V. V. Plasma renin activity - גורם סיכון ויעד עצמאי לטיפול בהורדת לחץ דם: תפקידו של אלישקירן // Consilium Medicum. - ת' 11. - 2009. - מס' 10. - ש' 3-6.
24. Solomon S.D., Appelbaum E., Manning W.J. et al. השפעת מעכב רנין ישיר אליסקירן, לבד או בשילוב עם לוסארטן, בהשוואה ללוסארטן, על מסת חדר שמאל בחולים עם יתר לחץ דם והיפרטרופיה של חדר שמאל // ניסוי ה-Aliskiren Left Ventricular Assessment of Hypertrophy (ALLAY). הוצג בפני המכללה האמריקאית לקרדיולוגיה. המושב המדעי השנתי ה-57, 31 במרץ 2008.
25. מק. Murray J.V., Pitt B., Latini R. et al. השפעות של מעכב רנין ישיר דרך הפה aliskiren בחולים עם אי ספיקת לב סימפטומטית // מחזור-אי ספיקת לב. - 2008. - כרך. 1. - ש' 17-24.
26. Nakao N., Yoshimura A., Morita H. et al. טיפול משולב של חוסם קולטן אנגיוטנסין-II ומעכבי אנזים הממיר אנגיוטנסין במחלת כליות שאינה סוכרתית (COOPERATE): ניסוי אקראי מבוקר // Lancet. - 2003. - כרך. 361 (9352). - ש' 117-124.
27. Mann I.F., Schmieder R. E., Mc.Queen M. et al. תוצאות כליות עם Telmisartan, Ramipril, או שניהם, באנשים בסיכון גבוה לכלי דם (מחקר ONTARGET): מחקר רב מרכזי, אקראי, כפול סמיות ומבוקר // Lancet. - 2008. - כרך. 372 (9638). - ש' 547-553.
28. Chazova I.E., Fomin V.V., Paltseva E.M. מעכב רנין ישיר אליקירן - אפשרויות חדשות להגנה על הכליות ביתר לחץ דם עורקי // נפרולוגיה קלינית. - מס' 1. - 2009. - ג' 44-49.
29. Chazova I.E., Fomin V.V. מעכב רנין ישיר אליקירן: אפשרויות לתיקון של תסמונת לב-כליות // יתר לחץ דם מערכתי. - 2009. - מס' 4. - ג' 53-58.
30. אבחון וטיפול ביתר לחץ דם עורקי: המלצות רוסיות // יתר לחץ דם מערכתי. - 2010. - מס' 3. - ג' 5-26.
03.07.2012
386 צפיות
עם יתר לחץ דם עורקי (יתר לחץ דם), כמות האנזים רנין בדם גדלה. הדבר מוביל לעלייה מתמשכת וממושכת בכמות החלבון אנגיוטנסין 2 בדם וברקמות הגוף. אנגיוטנסין 2 הוא בעל אפקט כיווץ כלי דם, מקדם אצירת נתרן ומים בגוף, מה שמוביל לעלייה בלחץ הדם. רמה גבוהה של אנגיוטנסין 2 בדם וברקמות לאורך זמן גורמת לעלייה מתמשכת בלחץ הדם, כלומר ליתר לחץ דם עורקי. מעכב רנין - תרופה המתמזגת עם רנין, וכתוצאה מכך מנוטרל רנין ומאבד פעילות אנזימטית. דבר זה מוביל לירידה ברמת האנגיוטנסין 2 בדם וברקמות - לירידה בלחץ הדם.
ל-AT2 יש אפקט כיווץ כלי דם, מקדם שימור נתרן ומים בגוף. זה מוביל לעלייה ולעלייה בנפח הדם במחזור הדם. שנית, יש עלייה בעוצמת התכווצויות הלב. כל זה בסך הכל גורם לעלייה ב-(BP) הן הסיסטולי (העליון) והן הדיאסטולי (התחתון). ככל שרמת הרנין בדם גבוהה יותר, כך רמת ה-AT2 בדם גבוהה יותר, לחץ הדם גבוה יותר.
רצף התמורות האנזימטיות: רנין + אנגיוטנסין = אנגיוטנסין 1 + ACE = אנגיוטנסין 2, נקרא מערכת רנין-אנגיוטנסין (RAS)אוֹ מערכת רנין-אנגיוטנסין-אלדוסטרון (RAAS). בהפעלה (פעילות מוגברת) של ה-RAS הכוונה לעלייה ברמת הדם של Renin, AT2.
רמה גבוהה של רנין בדם מביאה לעלייה ברמת AT2 בדם וברקמות. רמה גבוהה של AT2 בדם וברקמות לאורך זמן גורמת לעלייה מתמשכת בלחץ הדם, כלומר -.
ירידה ברמת הרנין בדם מביאה לירידה ברמת AT2 בדם וברקמות - לירידה בלחץ הדם.
מעכב רנין- חומר תרופתי הנכנס לשילוב עם רנין, וכתוצאה מכך מנוטרל רנין, מאבד את פעילותו האנזימטית והפעילות האנזימטית של רנין בדם יורדת. רנין הקשור למעכבי רנין מאבד את יכולתו לפצח אנגיוטנזינוגן ל-AT1. במקביל, ישנה ירידה מקושרת ברמת AT2 בדם וברקמות - ירידה בלחץ הדם, ירידה בפעילות ה-RAS, שיפור בזרימת הדם, אספקת דם לאיברים ורקמות של ה-RAS. גוּף.
אליקירןהוא כיום מעכב רנין הראשון והיחיד איתו בוצעו כל שלבי הניסויים הקליניים ומומלץ לטיפול ביתר לחץ דם עורקי מאז 2007.
חומר רפואי אליקירןמיוצר על ידי תעשיית התרופות בשמות מסחריים (מסחריים):
- ראסילזבצורה של תרופה פשוטה המכילה רק חומר תרופתי אחד - אליקירן;
- קו ראסילזבצורת תרופה משולבת (מורכבת) המכילה שתי תרופות: מעכבת הרנין אליסקירן והתרופה המשתנת Hydrochlorothiazide (משתן סלורי, תיאזיד).
אתה יכול להוסיף את המשוב וההערות שלך על השימוש במעכב הרנין Aliskiren לטיפול ביתר לחץ דם עורקי להלן.
