Dowody paleontologiczne sugerują, że niektóre rośliny należące do grupy Eucaesalpinioideae były najstarszymi roślinami strączkowymi, które miały guzki.
We współczesnych gatunkach roślin strączkowych guzki stwierdzono na korzeniach wielu przedstawicieli rodziny Papilijonaceae.
Bardziej prymitywni filogenetycznie przedstawiciele takich rodzin jak Caesalpiniaceae Mimosaceae w większości przypadków nie tworzą guzków.
Spośród 13 000 gatunków (550 rodzajów) roślin strączkowych obecność guzków stwierdzono dotychczas tylko u około 1300 gatunków (243 rodzajów). Obejmuje to przede wszystkim gatunki roślin wykorzystywane w rolnictwie (ponad 200).
Po utworzeniu guzków rośliny strączkowe nabywają zdolność wchłaniania azotu atmosferycznego. Potrafią jednak odżywiać się związanymi formami azotu – solami amonowymi i kwasem azotowym. Tylko jedna roślina, Hedysarum coronarium, asymiluje tylko azot cząsteczkowy. Dlatego bez guzków w naturze roślina ta nie występuje.
Bakterie brodawkowe zaopatrują roślinę strączkową w azot, który jest wiązany z powietrza. Rośliny z kolei dostarczają bakteriom produktów przemiany węglowodanów oraz soli mineralnych potrzebnych im do wzrostu i rozwoju.
W 1866 roku słynny botanik i gleboznawca M.S. Woronin dostrzegł najmniejsze „cielęta” w guzkach na korzeniach roślin strączkowych. Voronin wysunął śmiałe jak na tamte czasy założenia: powiązał powstawanie guzków z działaniem bakterii, a wzmożony podział komórek tkanki korzeniowej z reakcją rośliny na bakterie, które wniknęły do korzenia.
20 lat później holenderski naukowiec Beijerinck wyizolował bakterie z guzków grochu, wyki, chiny, fasoli, seradeli i lizaka i zbadał ich właściwości, testując zdolność do infekowania roślin i powodowania powstawania guzków. Nazwał te mikroorganizmy Bacillus radicicola. Ponieważ bakterie tworzące zarodniki należą do rodzaju Bacillus, a bakterie guzkowe nie mają tej zdolności, A. Prazhmovsky przemianował je na Bacterium radicicola. B. Frank zaproponował bardziej udaną nazwę rodzajową dla bakterii guzkowych - Rhizobium (od greckiego rhizo - korzeń, bio - życie; życie na korzeniach). Ta nazwa zakorzeniła się i jest nadal używana w literaturze.
W celu określenia gatunku bakterii brodawkowych zwyczajowo dodaje się termin do nazwy rodzajowej Rhizobium odpowiadającej łacińskiej nazwie gatunku rośliny, z której guzków są izolowane i na których mogą tworzyć guzki. Na przykład Rhizobium trifolii - bakteria brodawkowata koniczyny, Rhizobium lupini - bakteria brodawkowata łubinu itp. W przypadkach, gdy bakterie brodawkowe są zdolne do tworzenia brodawek na korzeniach różnych rodzajów roślin strączkowych, tj. Wywołują tzw. umiejętność. Na przykład Rhizobium leguminosarum - bakteria brodawkowata grochu (Pisum), soczewicy (Lens), szeregów (Lathyrus).
Morfologia i fizjologia bakterii brodawkowych - bakterie brodawkowe charakteryzują się niesamowitą różnorodnością form - polimorfizmem. Wielu badaczy zwracało na to uwagę, badając bakterie brodawkowe w czystej kulturze w warunkach laboratoryjnych iw glebie. Bakterie guzkowe mogą mieć kształt pręta i owalny. Wśród tych bakterii są również formy filtrowalne, formy L, organizmy kokosowe nieruchome i ruchome.
Młode bakterie brodawkowe w czystej kulturze na pożywce mają zwykle kształt pałeczki, wielkość pałeczek to około 0,5-0,9 X 1,2-3,0 mikrona, ruchliwe, mnożenie przez podział. W pręcikowatych komórkach bakterii guzkowych koniczyny obserwuje się podział przez ligację. Z wiekiem komórki w kształcie pręcików mogą przejść do pączkowania. Według Grama komórki barwią się ujemnie, ich ultradrobna struktura jest typowa dla bakterii Gram-ujemnych.
Z wiekiem bakterie brodawkowe tracą swoją ruchliwość i przechodzą w stan tzw. pręcików opasanych. Otrzymali tę nazwę ze względu na naprzemienność gęstych i luźnych odcinków protoplazmy w komórkach. Prążkowanie komórek jest dobrze wykrywane podczas oglądania pod mikroskopem świetlnym po traktowaniu komórek barwnikami anilinowymi. Gęste fragmenty protoplazmy (obręcz) są wybarwione gorzej niż przestrzenie między nimi. W mikroskopie fluorescencyjnym prążki są jasnozielone, przestrzenie między nimi nie świecą i wyglądają na ciemne.Prążki mogą znajdować się w środku celi lub na jej końcach. Opasanie komórek jest również widoczne na wzorach dyfrakcji elektronów, jeśli preparat nie zostanie poddany działaniu środka kontrastowego przed obejrzeniem. Prawdopodobnie z wiekiem komórka bakteryjna zapełnia się inkluzjami tłuszczowymi, które nie dostrzegają koloru iw efekcie powodują prążkowanie komórki. Etap „pręcików pasiastych” poprzedza etap powstawania bakteroidów – komórek o nieregularnym kształcie: zgrubiałych, rozgałęzionych, kulistych, gruszkowatych i kolbowatych, niż pałeczkowate komórki bakteryjne występujące w tkankach guzkowych.
Bakteroidy zawierają więcej ziarnistości wolutyny i charakteryzują się wyższą zawartością glikogenu i tłuszczu niż komórki pałeczkowate. Bacteroides hodowane w sztucznych pożywkach i powstające w tkankach brodawek są fizjologicznie tego samego typu. Uważa się, że bakterioidy są formami bakterii o niepełnym procesie podziału. Przy niepełnym podziale komórek bakterii brodawkowych powstają dychotomicznie rozgałęzione formy bakteroidów. Liczba bakteroidów wzrasta wraz ze starzeniem się kultury; ich pojawienie się ułatwia wyczerpanie pożywki, nagromadzenie produktów przemiany materii i wprowadzenie do pożywki alkaloidów.
Ryż. 3
W starych (dwumiesięcznych) kulturach bakterii brodawkowatych, przy użyciu mikroskopu elektronowego, można zidentyfikować w wielu komórkach wyraźnie określone formacje kuliste - artrospory. Ich liczba w komórkach waha się od 1 do 5.
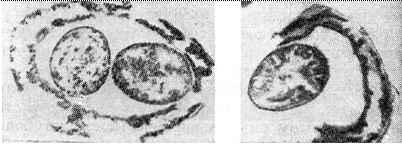
Ryż. 4
Bakterie brodawkowe różnych typów roślin strączkowych rosną w różnym tempie na pożywkach. Szybko rosnące bakterie obejmują ryzobium grochu, koniczyny, lucerny, fasoli pastewnej, wyki, soczewicy, chiny, koniczyny słodkiej, kozieradki, fasoli, ciecierzycy i ptasiej łapki; do wolno rosnących - bakterie brodawkowe łubinu, soi, orzeszków ziemnych, seradeli, fasoli mung, wspięgi, esparcety, janowca. W pełni ukształtowane kolonie kultur szybko rosnących można uzyskać w 3-4 dniu inkubacji, kolonie kultur wolno rosnących – w 7-8 dniu.
Szybko rosnące bakterie brodawkowe charakteryzują się perytrychalnym układem wici, podczas gdy wolno rosnące bakterie są monotrychialne.
Oprócz wici, w komórkach bakterii brodawkowych podczas wzrostu na płynnych pożywkach powstają nitkowate i koralikowate wyrostki, których długość sięga 8-10 mikronów. Zlokalizowane są zwykle na powierzchni komórki peritrichium, zawierają od 4 do 10 lub więcej na komórkę.
Kolonie szybko rosnących bakterii brodawkowych mają barwę pieczonego mleka, często prześwitują, są śluzowate, o gładkich brzegach, umiarkowanie wypukłe i ostatecznie wyrastają na powierzchni podłoża agarowego. Kolonie wolno rosnących bakterii są bardziej wypukłe, małe, suche, gęste i z reguły nie rosną na powierzchni podłoża. Śluz wytwarzany przez bakterie brodawkowe jest złożonym związkiem typu polisacharydowego, w skład którego wchodzą heksozy, pentozy i kwasy uronowe.
Bakterie guzkowe są mikroaerofilami (rozwijają się przy niewielkiej ilości tlenu w środowisku), jednak preferują warunki tlenowe.
Bakterie brodawkowe wykorzystują węglowodany i kwasy organiczne jako źródło węgla w pożywkach oraz różne mineralne i organiczne związki zawierające azot jako źródło azotu. Bakterie brodawkowe hodowane na podłożach z dużą zawartością substancji zawierających azot mogą utracić zdolność penetracji rośliny i tworzenia brodawek. Dlatego bakterie brodawkowe są zwykle hodowane na ekstraktach roślinnych (bulion z fasoli, grochu) lub ekstraktach glebowych. Niezbędny do rozwoju fosfor mogą być pozyskiwane przez bakterie brodawkowe z mineralnych i organicznych związków zawierających fosfor; związki mineralne mogą służyć jako źródło wapnia, potasu i innych pierwiastków mineralnych.
W celu stłumienia obcej mikroflory saprofitycznej podczas izolowania bakterii brodawkowych z guzków lub bezpośrednio z gleby zaleca się stosowanie pożywek z dodatkiem fioletu krystalicznego, garbników lub antybiotyków.
Do rozwoju większości kultur bakterii brodawkowych wymagana jest optymalna temperatura w zakresie 24-26°. W temperaturze 0° i 37°C wzrost zatrzymuje się. Zwykle kultury bakterii brodawkowych przechowuje się w warunkach laboratoryjnych w niskich temperaturach (2-4°C).
Wiele rodzajów bakterii brodawkowych jest w stanie syntetyzować witaminy z grupy B, a także substancje wzrostowe, takie jak heteroauksyna (kwas beta-indolooctowy).
Wszystkie bakterie brodawkowe są w przybliżeniu jednakowo odporne na odczyn zasadowy podłoża (pH = 8,0), ale nierówno wrażliwe na odczyn kwaśny.
Swoistość, wirulencja, konkurencyjność i aktywność bakterii brodawkowych - pojęcie specyficzności bakterii brodawkowych jest pojęciem zbiorowym. Charakteryzuje zdolność bakterii do tworzenia guzków w roślinach. Jeśli mówimy ogólnie o bakteriach brodawkowych, to dla nich tworzenie się brodawek tylko w grupie roślin strączkowych jest już samo w sobie specyficzne - mają one selektywność względem roślin strączkowych.
Jeśli jednak weźmiemy pod uwagę poszczególne kultury bakterii brodawkowych, okazuje się, że są wśród nich takie, które są w stanie zainfekować tylko pewną, czasem większą, czasem mniejszą, grupę roślin strączkowych i w tym sensie specyfika bakterii brodawkowych jest zdolnością selektywną w stosunku do rośliny żywicielskiej. Specyficzność bakterii brodawkowych może być wąska (bakterie brodawkowe koniczyny porażają tylko grupę koniczyn – specyficzność gatunkowa, a bakterie brodawkowe łubinu mogą charakteryzować się nawet specyficznością odmianową – infekują tylko alkaloidowe lub wolne od alkaloidów odmiany łubinu). Z szeroką specyficznością bakterie brodawkowe grochu mogą infekować rośliny grochu, brody i fasoli, a bakterie brodawkowe grochu i fasoli mogą infekować rośliny grochu, tj. Wszystkie charakteryzują się zdolnością do „zakażania krzyżowego”. Specyfika bakterii brodawkowych leży u podstaw ich klasyfikacji.
Specyfika bakterii brodawkowych powstała w wyniku ich wieloletniego przystosowania się do jednej rośliny lub ich grupy oraz genetycznego przeniesienia tej właściwości. Pod tym względem istnieje również inna zdolność adaptacji bakterii brodawkowych do roślin w grupie infekcji krzyżowej. Tak więc bakterie brodawkowe lucerny mogą tworzyć guzki w koniczynie słodkiej. Niemniej jednak są one bardziej przystosowane do lucerny, a bakterie koniczyny słodkiej są bardziej przystosowane do koniczyny słodkiej.
W procesie zakażenia systemu korzeniowego roślin strączkowych bakteriami brodawkowymi duże znaczenie ma wirulencja mikroorganizmów. Jeśli specyficzność określa spektrum działania bakterii, to wirulencja bakterii brodawkowych charakteryzuje aktywność ich działania w tym spektrum. Wirulencja odnosi się do zdolności bakterii guzkowych do penetracji tkanki korzenia, namnażania się tam i powodowania powstawania guzków.
Ważną rolę odgrywa nie tylko sama zdolność wnikania w korzenie rośliny, ale także szybkość tej penetracji.
Aby określić zjadliwość szczepu bakterii guzkowych, konieczne jest ustalenie jego zdolności do wywoływania powstawania guzków. Kryterium zjadliwości dowolnego szczepu może być minimalna liczba bakterii, która zapewnia bardziej energiczną infekcję korzeni w porównaniu z innymi szczepami, której kulminacją jest tworzenie się guzków.

Ryż. 5
W glebie, w obecności innych szczepów, bardziej zjadliwy szczep nie zawsze zaraża roślinę jako pierwszy. W tym przypadku należy wziąć pod uwagę jego zdolność konkurencyjną, która często maskuje właściwość zjadliwości w warunkach naturalnych.
Konieczne jest, aby szczepy wirulentne posiadały również konkurencyjność, tj. mogły z powodzeniem konkurować nie tylko z przedstawicielami lokalnej mikroflory saprofitycznej, ale także z innymi szczepami bakterii brodawkowych. Wskaźnikiem konkurencyjności szczepu jest liczba utworzonych przez niego guzków jako procent całkowitej liczby guzków na korzeniach roślin.
Ważną właściwością bakterii brodawkowych jest ich aktywność (wydajność), tj. zdolność w symbiozie z roślinami strączkowymi do asymilacji azotu cząsteczkowego i zaspokajania w nim potrzeb rośliny żywicielskiej. W zależności od tego, w jakim stopniu bakterie brodawkowe przyczyniają się do wzrostu plonowania roślin strączkowych, dzieli się je zazwyczaj na aktywne (skuteczne), nieaktywne (nieefektywne) i nieaktywne (nieefektywne).
Szczep bakterii nieaktywny dla jednej rośliny żywicielskiej w symbiozie z innym gatunkiem rośliny strączkowej może być dość skuteczny. Dlatego też, charakteryzując szczep pod kątem jego skuteczności, należy zawsze wskazać, w stosunku do jakiego gatunku rośliny żywicielskiej przejawia się jego działanie.
Aktywność bakterii brodawkowych nie jest ich stałą właściwością. W praktyce laboratoryjnej często dochodzi do utraty aktywności w kulturach bakterii brodawkowych. W takim przypadku albo aktywność całej hodowli zostaje utracona, albo pojawiają się pojedyncze komórki o niskiej aktywności. Spadek aktywności bakterii guzkowych występuje w obecności niektórych antybiotyków, aminokwasów. Jedną z przyczyn utraty aktywności bakterii brodawkowych może być wpływ faga. Poprzez pasażowanie, czyli wielokrotne przepuszczanie bakterii przez roślinę żywicielską (adaptacja do określonego gatunku rośliny), możliwe jest uzyskanie szczepów skutecznych z nieskutecznych.
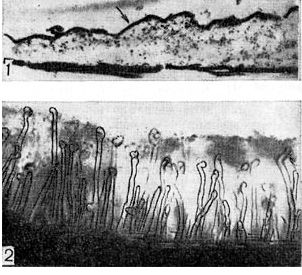
Ryż. 6 - Warstwa substancji ziarnistej na powierzchni włośników (1) w badaniu mikroskopem elektronowym (wg P. Dart, F. Mercer, powiększenie X 30 000) oraz śluzowata warstwa zoogley (2), w której znajdują się włośniki koniczyny zanurzony, pod mikroskopem świetlnym (zoom x 80)
Ekspozycja na promieniowanie gamma umożliwia uzyskanie szczepów o zwiększonej wydajności. Znane są przypadki pojawienia się wysoce aktywnych radiomutantów bakterii brodawkowych lucerny z nieaktywnego szczepu. Zastosowanie promieniowania jonizującego, które ma bezpośredni wpływ na zmianę cech genetycznych komórki, najprawdopodobniej może być obiecującą techniką w selekcji wysoce aktywnych szczepów bakterii brodawkowych.
Zakażenie roślin strączkowych bakteriami brodawkowatymi - aby zapewnić prawidłowy proces zakażenia systemu korzeniowego bakteriami brodawkowymi, konieczne jest posiadanie dość dużej liczby żywotnych komórek bakteryjnych w strefie korzeniowej.
Podczas rozwoju systemu korzeniowego rośliny strączkowej namnażanie się bakterii brodawkowych na powierzchni korzenia jest stymulowane przez wydzieliny korzeniowe. Produkty destrukcji czapeczek korzeniowych i włosków również odgrywają ważną rolę w dostarczaniu bakteriom brodawkowym odpowiedniego substratu.
Na powierzchni korzenia znajduje się warstwa substancji śluzowej (matrycy), która powstaje niezależnie od obecności bakterii w ryzosferze. Warstwa ta jest wyraźnie widoczna podczas badania pod mikroskopem optycznym. Bakterie brodawkowe po zaszczepieniu zwykle pędzą do tej warstwy i gromadzą się w niej dzięki stymulującemu działaniu korzenia, które objawia się nawet w odległości do 30 mm.
Istnieje wiele hipotez dotyczących mechanizmu przenikania bakterii brodawkowych do korzeni roślin. Najciekawsze z nich są następujące. Autorzy jednej z hipotez twierdzą, że bakterie brodawkowe wnikają do korzenia poprzez uszkodzenie tkanki naskórkowej i korowej (zwłaszcza w miejscach odgałęzień korzeni bocznych). Hipoteza ta została wysunięta na podstawie badań Brila (1888), który spowodował powstawanie brodawek w roślinach strączkowych poprzez nakłuwanie korzeni igłą uprzednio zanurzoną w zawiesinie bakterii brodawkowatych. W szczególnym przypadku taka ścieżka implementacji jest całkiem realna. Na przykład w orzeszkach ziemnych guzki są zlokalizowane głównie w kątach gałęzi korzeni, co sugeruje penetrację bakterii brodawkowych do korzenia przez szczeliny podczas kiełkowania korzeni bocznych.
Ciekawą i nie bezpodstawną hipotezą jest przenikanie bakterii brodawkowych do tkanki korzeniowej przez włośniki. Przejście bakterii brodawkowych przez włośniki jest rozpoznawane przez większość badaczy.
Możliwe, że bakterie brodawkowe mogą wniknąć do korzenia przez komórki naskórka młodych wierzchołków korzeni. Według Prazhmovsky'ego (1889) bakterie mogą penetrować korzeń tylko przez młodą ścianę komórkową (włośników lub komórek naskórka) i są całkowicie niezdolne do pokonania zmienionej chemicznie lub korkowatej warstwy kory. Może to wyjaśniać, że guzki zwykle rozwijają się na młodych odcinkach głównego korzenia i wyłaniających się korzeni bocznych.
Ostatnio dużą popularność zyskała hipoteza auksyny. Autorzy tej hipotezy uważają, że bakterie brodawkowe wnikają do korzeni poprzez stymulację syntezy kwasu p-indolooctowego (heteroauksyny) z tryptofanu, który jest zawsze obecny w wydzielinach korzeni roślin. Obecność heteroauksyny wiąże się ze skrzywieniem włośników, co zwykle obserwuje się w przypadku zakażenia systemu korzeniowego bakteriami brodawkowymi.
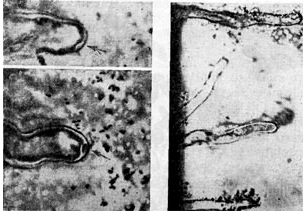
Ryż. 7
Źródłem kwasu beta-indolilooctowego w momencie infekcji rośliny są oczywiście nie tylko rośliny wydzielające tryptofan przez system korzeniowy, który wiele rodzajów bakterii, w tym brodawki korzeniowe, może przekształcić w kwas beta-indolilooctowy. W syntezie heteroauksyny mogą również uczestniczyć same bakterie brodawkowe i prawdopodobnie inne rodzaje mikroorganizmów glebowych żyjących w strefie korzeniowej.
Działanie heteroauksyny jest niespecyficzne i powoduje skrzywienie włośników u różnych gatunków roślin, nie tylko roślin strączkowych. Jednocześnie bakterie brodawkowe powodują skrzywienie włośników tylko u roślin strączkowych, wykazując przy tym dość znaczną selektywność. Gdyby rozpatrywany efekt był determinowany tylko przez kwas β-indolooctowy, to taka specyficzność by nie istniała.Dodatkowo charakter zmian we włośnikach pod wpływem bakterii brodawkowych jest nieco inny niż pod wpływem heteroauksyny.
Należy również zauważyć, że w niektórych przypadkach niezakrzywione włośniki są narażone na infekcję. Z obserwacji wynika, że w lucernie i grochu 60-70% włośników jest skręconych i skręconych, aw koniczynie około 50%. U niektórych gatunków koniczyny reakcja ta występuje w nie więcej niż 1/4 zakażonych włosków. Oczywiście w reakcji na krzywiznę ogromne znaczenie ma stan włośnika. Rosnące włośniki są najbardziej wrażliwe na działanie substancji wytwarzanych przez bakterie.
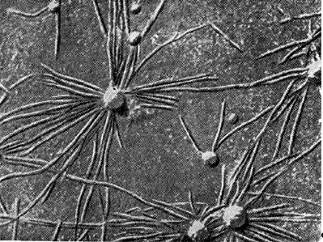
Ryż. 8
brodawkowata bakteria azotowa roślin strączkowych
Należy zwrócić uwagę na inną hipotezę, zgodnie z którą bakterie brodawkowe dostają się do korzenia podczas tworzenia palcowej wypukłości na powierzchni włośnika. Dyfraktogram elektronów fragmentu włośnika potwierdzający tę hipotezę pokazuje wygięty włośnik w kształcie rączki parasolki, w której zagięciu nagromadziły się bakterie brodawkowate. Bakterie brodawkowe są jakby wciągane (połykane) przez włośnik (podobnie jak pinocytoza).
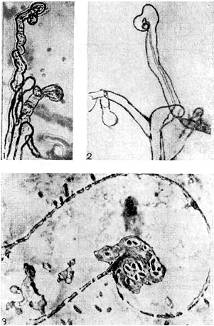
Ryż. 9 - Krzywizna włośników roślin strączkowych w obecności bakterii brodawkowatych: 1,2 - stuła, x 120; 3 - ultracienkie przekrój przez włośnik. Zwiększony X 10 000 (według K. Salmana i G. Fareusa)
Proces wprowadzania bakterii brodawkowych do tkanki korzeniowej jest taki sam we wszystkich typach roślin strączkowych i składa się z dwóch faz. W pierwszej fazie dochodzi do zakażenia włośników. W drugiej fazie proces powstawania guzków przebiega intensywnie. Czas trwania faz jest różny u różnych gatunków roślin: u Trifolium fragiferum pierwsza faza trwa 6 dni, u Trifolium nigrescens 3 dni. W niektórych przypadkach bardzo trudno jest wykryć granice między fazami. Najintensywniejsze wprowadzanie bakterii brodawkowych do włośników następuje we wczesnych stadiach rozwoju roślin. Druga faza kończy się podczas masowego tworzenia się guzków. Często penetracja bakterii brodawkowych do włośników trwa nawet po utworzeniu się guzków na korzeniach. Ta tak zwana nadmierna lub dodatkowa infekcja występuje, ponieważ infekcja włosów nie ustaje przez długi czas. W późniejszych stadiach infekcji guzki są zwykle umiejscowione niżej wzdłuż korzenia.
Po wniknięciu do korzenia (przez włośnik, komórkę naskórka, miejsca uszkodzenia korzenia) bakterie brodawkowe przemieszczają się następnie do tkanek korzenia rośliny. Najłatwiej bakterie przechodzą przez przestrzenie międzykomórkowe.
Pojedyncza komórka lub grupa komórek bakteryjnych może przeniknąć do tkanki korzenia. Jeśli wprowadzono oddzielną komórkę, może ona dalej poruszać się w tkance jako pojedyncza komórka. Charakterystyczny dla roślin łubinu jest sposób porażenia korzeni przez pojedyncze komórki.
Jednak w większości przypadków atakująca komórka, aktywnie namnażając się, tworzy tzw.
Termin „nici infekcji” powstał na podstawie badania procesu infekcji pod mikroskopem świetlnym. Począwszy od prac Beijerincka, nić infekcyjną zaczęto uważać za śluzowatą, podobną do strzępek masę z zamkniętymi
Zgodnie z metodą powstawania guzki roślin strączkowych dzielą się na dwa typy: 1. typ - guzki powstają podczas podziału komórek pericyklu (warstwa korzenia), zwykle zlokalizowanego naprzeciw protoksylemu (pierwszy w czasie do tworzenia naczyń ) - endogenny typ powstawania guzków; Typ 2 – guzki powstają z kory korzenia w wyniku wprowadzenia patogenu do komórek miąższowych kory i endodermy (wewnętrznej warstwy kory pierwotnej) – egzogenny rodzaj powstawania guzków.
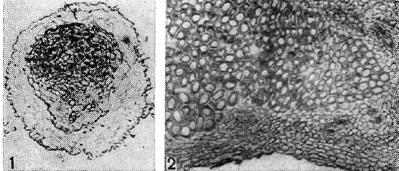
Ryż. 10 - Przekroje przez tkankę brodawkową roślin strączkowych: 1 - przekrój przez brodawkę grochu. Początek różnicowania tkanki naczyniowej w guzku (wg G. Bonda); d - przekrój podłużny przez guzek rangi. Zwiększony x90
W naturze dominuje ten drugi typ. Tkanki centralnego cylindra korzenia biorą udział tylko w tworzeniu układu naczyniowego guzków zarówno endogennych, jak i egzogennych.
Różnicę w charakterze tworzenia się guzków i korzeni bocznych widać szczególnie wyraźnie u Seradelli, ponieważ tkanka korowa głównego korzenia tej rośliny – miejsce powstania pierwszych guzków – składa się ze stosunkowo niewielkiej warstwy komórek, a guzki stają się widoczne bardzo szybko po zakażeniu korzenia bakteriami. Najpierw tworzą spłaszczone wypukłości na korzeniu, co pozwala odróżnić je od stożkowych wypukłości korzeni bocznych. Guzki różnią się od korzeni bocznych szeregiem cech anatomicznych: brakiem centralnego cylindra, czapeczek i naskórka oraz obecnością znacznej warstwy kory pokrywającej guzek.
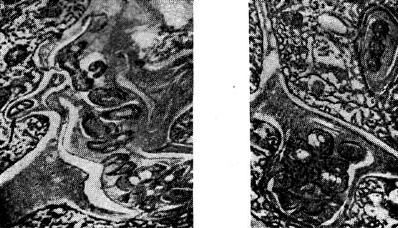
Ryż. jedenaście - Nici zakażenia międzykomórkowego w postaci kieszonki (po prawej) i pochodni (po lewej) z bakteriami guzkowymi. Strzałka pokazuje komórkę bakteryjną przygotowującą się do wejścia do cytoplazmy komórki roślinnej. Zwiększony X 20 000
Tworzenie się guzków roślin strączkowych następuje w okresie, gdy korzeń ma jeszcze pierwotną strukturę. Rozpoczyna się podziałem komórek korowych znajdujących się w odległości 2-3 warstw od końców nici infekcyjnych. Warstwy kory, penetrowane przez zakaźne nici, pozostają niezmienione. Jednocześnie u seradeli podział komórek korowych następuje bezpośrednio pod porażonym włośnikiem, podczas gdy u grochu podział komórek obserwuje się tylko w przedostatniej warstwie kory.
Podział z utworzeniem promieniowej struktury tkanki trwa do wewnętrznych komórek rdzenia. Występuje bez określonego kierunku, losowo, w wyniku czego powstaje merystem (system tkanek wykształceniowych) guzka, składający się z małych komórek ziarnistych.
Zmieniają się podzielone komórki kory: jądra są zaokrąglone i powiększają się, zwłaszcza jąderka. Po mitozie jądra rozpraszają się i nie przyjmując swojej pierwotnej formy, ponownie zaczynają się dzielić.
Pojawia się merystem wtórny. Wkrótce w endodermie i perycyklu pojawiają się oznaki początkowego podziału, który w dawnych komórkach zewnętrznych zachodzi głównie przez przegrody styczne. Podział ten ostatecznie rozciąga się na wspólny kompleks merystematyczny, którego małe komórki są wydłużone, wakuole znikają, jądro wypełnia większość komórki. Powstaje tzw. guzek pierwotny, w osoczu komórek, w których bakterie guzkowe są nieobecne, ponieważ na tym etapie znajdują się one jeszcze wewnątrz nici infekcji. Podczas formowania się guzka pierwotnego nitki infekcji rozgałęziają się wielokrotnie i mogą przechodzić między komórkami – międzykomórkowo lub przez komórki – wewnątrzkomórkowo – i wprowadzać bakterie.
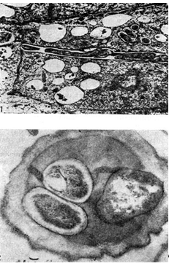
Ryż. 12 - Wewnątrzkomórkowe nici infekcyjne z bakteriami guzkowymi: 1 - przekrój podłużny (wg D. Goodchilda i F. Bergersena), 2 - przekrój poprzeczny. Wyprowadzony, x 35000
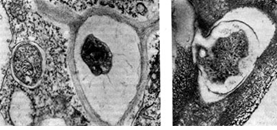
Międzykomórkowe nici zakaźne z powodu aktywnego rozmnażania się w nich bakterii guzkowych często przybierają dziwaczny kształt - powstają w postaci kieszeni (uchyłków) lub pochodni.
Proces przemieszczania się nici infekcyjnych z komórki do komórki nie jest do końca wyjaśniony. Najwyraźniej nici infekcyjne, jak uważa kanadyjski mikrobiolog D. Jordan, wędrują w postaci nagich pasm śluzowych w przestrzeniach międzykomórkowych tkanki roślinnej, aż z niewyjaśnionych jeszcze przyczyn zaczną wnikać w cytoplazmę sąsiednich komórek.
W niektórych przypadkach inwazja nici infekcji występuje w jednym, w niektórych przypadkach - w każdej sąsiedniej komórce. Przez te wklęsłe rurkowate jamy (uchyłki) zawartość nici zamkniętej w śluzie przepływa. Najbardziej aktywny wzrost nici infekcyjnych występuje zwykle w pobliżu jądra komórki roślinnej. Wnikaniu nici towarzyszy ruch jądra, które przemieszcza się w kierunku miejsca zakażenia, powiększa się, zmienia kształt i ulega degeneracji. Podobny obraz obserwuje się w zakażeniu grzybiczym, kiedy jądro często pędzi w stronę atakujących strzępek, przyciąga uszkodzenie jako miejsce największej aktywności fizjologicznej, zbliża się do nici, pęcznieje i zapada. Najwyraźniej jest to charakterystyczne dla odpowiedzi rośliny na infekcję.
U roślin jednorocznych nicienie infekcyjne pojawiają się zwykle w pierwszym okresie porażenia korzenia, u roślin wieloletnich – w długim okresie rozwoju.
Ryż. 13
Bakterie mogą być uwalniane z nici infekcji w różnym czasie i na różne sposoby. Wyjście bakterii jest z reguły bardzo długim procesem, szczególnie w przypadku roślin wieloletnich. Zwykle uwalnianie bakterii z nitki infekcyjnej do cytoplazmy rośliny żywicielskiej wiąże się z ciśnieniem wewnętrznym wynikającym z intensywnego namnażania się bakterii w nitce i wydalania przez nie śluzu. Czasami bakterie wyślizgują się z nici w grupach otoczonych śluzem nitki infekcyjnej. w postaci pęcherzyków (formacje pęcherzykowe). Ponieważ pęcherzyki nie mają błon, wyjście bakterii z nich jest bardzo proste. Bakterie brodawkowe mogą również wnikać do komórek roślinnych pojedynczo z przestrzeni międzykomórkowych.
Bakterie guzkowe, które wyłoniły się z nici infekcji, nadal namnażają się w tkance żywiciela. Ich rozmnażanie w tym okresie odbywa się przez podział zwężający. Większość bakterii namnaża się w cytoplazmie komórki, a nie w nici infekcyjnej. Zainfekowane komórki dają początek przyszłej tkance bakteroidalnej.
Wypełnione szybko namnażającymi się komórkami bakterii brodawkowych, komórki roślinne zaczynają się intensywnie dzielić. W momencie podziału mitotycznego zakażonych komórek bakterie brodawkowe mogą gromadzić się na dwóch przeciwległych biegunach komórki macierzystej i biernie wnikać do komórek potomnych. Każda z niezainfekowanych komórek znajduje się pod silnym stymulującym działaniem bakterii brodawkowych iw efekcie również ulega podziałom. Dzięki temu energicznemu podziałowi mitotycznemu komórek merystematycznych bakterie brodawkowe rozprzestrzeniają się do tkanek brodawkowych i zwiększa się objętość obszaru bakteroidowego.
Zainfekowana tkanka, złożona z gęsto leżących i aktywnie dzielących się komórek, ma najpierw kształt ściętego stożka. Następnie, w wyniku stopniowego wzrostu tego stożka i jednoczesnego podziału i rozwoju komórek merystematycznych, tkanka guzkowa rozrasta się, tracąc stożkowaty kształt.
Tak więc guzek powiększa się najpierw w wyniku promieniowego i stycznego podziału komórek rdzenia, a następnie w wyniku wzrostu ich wielkości i jednoczesnego podziału. Po całkowitym wypełnieniu komórek roślinnych bakteriami mitoza zatrzymuje się. Jednak komórki nadal powiększają się i często są bardzo wydłużone. Ich wielkość jest kilkukrotnie większa niż komórek roślin niezainfekowanych, które znajdują się pomiędzy nimi w strefie bakteroidowej brodawki.
Połączenie młodego guzka z korzeniem rośliny strączkowej odbywa się dzięki wiązkom naczyniowo-włóknistym. Po raz pierwszy naczyniowe wiązki włókniste zaobserwował M.S. Woronina (1866). Czas występowania układu naczyniowego w brodawkach różnych rodzajów roślin strączkowych jest różny. Tak więc w brodawkach sojowych początek rozwoju wiązek naczyniowych zbiega się z momentem penetracji bakterii brodawkowych do dwóch warstw miąższu krowy. Wraz ze wzrostem guzka system przewodzący rośnie, rozgałęzia się i otacza region bakterioidalny.
Równolegle z procesem różnicowania układu naczyniowego z zewnętrznej warstwy guzka pierwotnego tworzy się endoderma guzka. Następnie guzek jest zaokrąglony, jego obwodowa warstwa komórek jest otoczona korą guzka.
Naskórek korzenia pęka, a guzek nadal się rozwija i powiększa.
Za pomocą mikroskopu świetlnego na przekrojach podłużnych dojrzałych guzków zwykle wyraźnie rozróżnia się 4 charakterystyczne strefy różnicowania tkanek: kora, merystem, strefa bakteroidowa i układ naczyniowy. Wszystkie tkanki guzków różnicują się w sekwencji akropetalnej, ponieważ nowe komórki są inicjowane przez merystem.
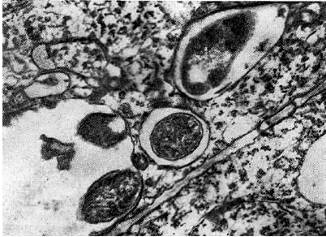
Ryż. 14
Kora guzka - skorupa guzka, która pełni funkcję ochronną. Kora składa się z kilku rzędów niezainfekowanych komórek miąższowych, których rozmiar i właściwości są różne u różnych roślin strączkowych. Najczęściej komórki kory mają wydłużony kształt i są większe w porównaniu z innymi komórkami guzka.
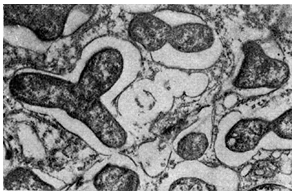
Ryż. 15
W korze guzków wieloletnich gatunków drzewiastych często znajdują się komórki z korkowatymi błonami zawierającymi żywice, garbniki i garbniki.
Merystem guzkowy znajduje się pod komórkami kory mózgowej i jest strefą intensywnie dzielących się również niezainfekowanych komórek. Merystem guzka charakteryzuje się gęsto rozmieszczonymi, bez przestrzeni międzykomórkowych, małymi, cienkościennymi komórkami o nieregularnym kształcie. Komórki merystemu guzkowego są podobne do komórek innych typów tkanki merystematycznej (wierzchołek korzenia, wierzchołek łodygi). Komórki merystemu guzkowego zawierają gęstą, drobnoziarnistą cytoplazmę z rybosomami, ciałami Golgiego, protoplastami, mitochondriami i innymi strukturami. Są małe wakuole. W centrum cytoplazmy znajduje się duże jądro z błoną jądrową, porami i wyraźnie określonym jąderkiem. Funkcje komórek merystematycznych polegają na tworzeniu komórek kory guzka, regionu bakteroidowego i układu naczyniowego. W zależności od umiejscowienia merystemu guzki mają różne kształty: kuliste (groch, fasola, seradela, orzeszki ziemne) lub cylindryczne (lucerna, wyka, ranga, akacja, koniczyna). Merystem, zlokalizowany w oddzielnych obszarach wzdłuż obwodu guzka, prowadzi do powstawania mufowatych guzków u łubinu.
Merystem guzkowy funkcjonuje przez długi czas, nawet podczas martwicy guzków, kiedy są one już wypełnione rozkładającą się masą bakteroidową i zniszczonymi komórkami roślinnymi.
Strefa bakteroidowa guzka zajmuje jego centralną część i stanowi od 16 do 50% całkowitej suchej masy guzka. W pierwszym okresie powstawania guzków jest to zasadniczo strefa bakteryjna, ponieważ jest wypełniona komórkami bakteryjnymi, które znajdują się w fazie rozwoju bakteryjnego, a nie bakterioidalnego. Niemniej jednak, jeśli chodzi o strefę tkanki guzkowej zawierającą bakterie, zwyczajowo nazywa się ją bakterioidą.
Obszar bakteroidalny brodawki składa się głównie z komórek zakażonych bakteriami brodawkowymi i częściowo sąsiadujących z nimi niezainfekowanych komórek, wypełnionych barwnikami, garbnikami, a jesienią skrobią.
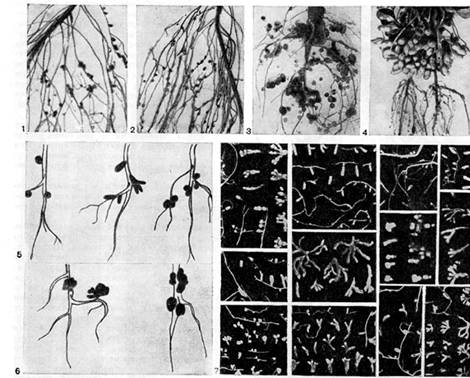
Ryż. 16 - Postać brodawkowata u roślin strączkowych: 1, 2 - groch; 3, 6 (po prawej) - łubin; 4 - orzeszki ziemne (wg E. Schwinghamer); 5 - stopnie, koniczyna, wiki, 6 (po lewej) - lucerna (wg. J. Date); 7 - różne rodzaje dzikich roślin strączkowych (wg A.R. Werner, N.Ya. Gordienko)
W guzkach utworzonych przez skuteczne szczepy bakterii brodawkowych średnia względna objętość strefy bakteroidów jest większa niż w guzkach utworzonych po wprowadzeniu szczepów nieefektywnych.
W niektórych przypadkach objętość obszaru bakteroidowego osiąga maksimum we wczesnym okresie życia guzka, a następnie pozostaje względnie stała. Strefa bakteroidów jest penetrowana przez gęstą sieć nici zakaźnych i jest otoczona naczyniowymi wiązkami włóknistymi wzdłuż obwodu.
Postać bakteroidów w brodawkach różnych rodzajów roślin strączkowych może być różna. Tak więc na wiki, rank and pea, są one rozgałęzione lub rozwidlone. W przypadku koniczyny i esparcety dominującą formą bakteroidów jest sferyczna, gruszkowata, spęczniała, jajowata i okrągła w przypadku ciecierzycy. Kształt bakteroidów fasoli, seradeli, ptasiej stopy i łubinu jest prawie w kształcie pręta.
Bacteroides wypełniają większość komórki roślinnej, z wyjątkiem centralnej strefy jądra i wakuoli. Tak więc odsetek bakteroidów w strefie bakteroidowej różowego guzka wynosi 94,2 całkowitej liczby bakterii guzkowych. Komórki bakteroidalne są 3-5 razy większe niż komórki bakteryjne.
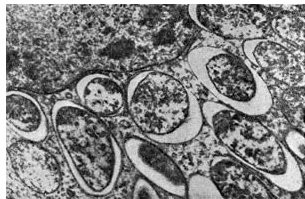
Ryż. 17
Bacteroides bakterii brodawkowych są szczególnie interesujące ze względu na to, że są one niemal jedynymi mieszkańcami brodawek roślin strączkowych w okresie intensywnego wiązania przez nie azotu atmosferycznego. Niektórzy badacze uważają bakteroidy za patologiczne formy zwyrodnieniowe i nie wiążą procesu wiązania azotu z bakteroidową postacią bakterii guzkowych. Większość badaczy uważa, że bakteroidy są najbardziej żywotnymi i aktywnymi formami bakterii brodawkowych, a rośliny strączkowe wiążą azot atmosferyczny tylko przy ich udziale.
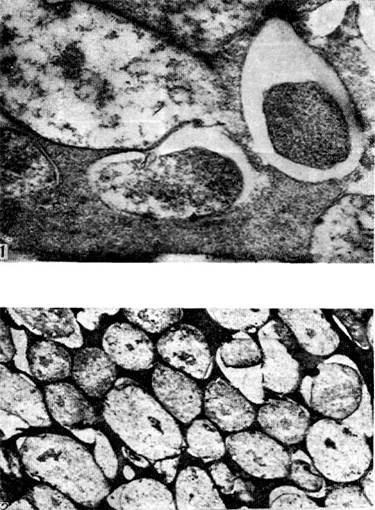
Ryż. 18
Układ naczyniowy guzka zapewnia połączenie między bakteriami a rośliną żywicielską. Składniki odżywcze i produkty przemiany materii są transportowane przez wiązki naczyniowe. Układ naczyniowy rozwija się wcześnie i funkcjonuje przez długi czas.
W pełni uformowane naczynia mają specyficzną budowę: składają się z tracheid ksylemu, włókien łyka, rurek sitowych i towarzyszących im komórek.
W zależności od rodzaju rośliny strączkowej połączenie kłębuszka odbywa się przez jedną lub więcej wiązek naczyniowych. Na przykład w grochu u podstawy guzka znajdują się dwa zróżnicowane węzły naczyniowe. Każdy z nich zwykle rozgałęzia się dychotomicznie dwukrotnie, w wyniku czego przez guzek przechodzi 8 wiązek z miejsca drugiego rozgałęzienia dychotomicznego. Wiele roślin ma tylko jeden pęczek, podczas gdy jednocześnie w jednym guzku Sesbania grandiflora w wieku jednego roku były w stanie policzyć do 126. Dość często układ naczyniowy guzka jest oddzielony od zewnętrznej strony jego kora przez warstwę częściowo lub całkowicie suberowanych komórek, zwaną endodermą guzkową, przyczepioną do endodermy korzenia. Endoderma guzka to zewnętrzna warstwa niezainfekowanego miąższu bydlęcego, zlokalizowana między tkanką guzka a korą korzenia.
U większości gatunków roślin guzki powstają zgodnie z opisanym typem. Dlatego powstawanie guzków jest wynikiem złożonych zjawisk rozpoczynających się poza korzeniem. Po początkowych fazach infekcji indukowane jest tworzenie się guzka, następnie następuje rozprzestrzenianie się bakterii w strefie tkanki guzkowej i wiązanie azotu.
Wszystkie etapy rozwoju bakterii brodawkowych, według czeskiego mikrobiologa V. Kasa (1928), można prześledzić na skrawkach brodawek. Na przykład w górnej części guzka lucerna zawiera głównie małe dzielące się komórki w kształcie pręcików, niewielką ilość młodych bakteroidów, których liczba stopniowo wzrasta w miarę rozwoju guzka. W środkowej, różowo zabarwionej części guzka znajdują się głównie komórki bakteroidalne, rzadziej małe komórki w kształcie pręcików. Bakteroidy u podstawy brodawki we wczesnych stadiach wegetacji rośliny żywicielskiej są takie same jak w jej środkowej części, ale pod koniec sezonu wegetacyjnego są bardziej spuchnięte i wcześniej ulegają degeneracji.
Czas pojawienia się pierwszych widocznych guzków na korzeniach różnych rodzajów roślin strączkowych jest różny. Ich pojawienie się u większości roślin strączkowych następuje najczęściej w czasie rozwoju pierwszych liści właściwych. Tak więc tworzenie się pierwszych guzków lucerny obserwuje się między 4 a 5 dniem po wykiełkowaniu, a w 7 - 8 dniu proces ten zachodzi u wszystkich roślin. Guzki lucerny sierpowatej pojawiają się po 10 dniach.
W okresie funkcjonowania guzki są zwykle gęste. Guzki utworzone przez aktywne kultury bakterii mają białawy kolor w młodym wieku. Do czasu manifestacji optymalnej aktywności stają się różowe. Guzki, które powstały podczas infekcji nieaktywnymi kulturami bakteryjnymi, mają zielonkawy kolor. Często ich budowa praktycznie nie różni się od struktury guzków powstałych przy udziale aktywnych szczepów bakterii brodawkowych, ale ulegają przedwczesnemu zniszczeniu.
W niektórych przypadkach struktura guzków tworzonych przez nieaktywne bakterie odbiega od normy. Wyraża się to dezorganizacją tkanki guzkowej, która zwykle traci wyraźnie określone zróżnicowanie strefowe.
Różowy kolor jest określony przez obecność pigmentu w guzkach, który jest podobny pod względem składu chemicznego do hemoglobiny krwi. Pod tym względem pigment nazywa się leghemoglobina (legoglobina) - hemoglobina Leguminosae. Legoglobina występuje tylko w tych komórkach guzków, które zawierają bakteroidy. Jest zlokalizowany w przestrzeni między bakterioidami a otaczającą je błoną.
Jego ilość waha się od 1 do 3 mg na 1 g guzka, w zależności od rodzaju rośliny strączkowej.
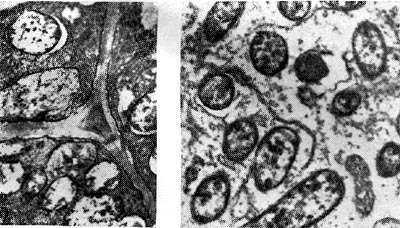
Ryż. 19
W jednorocznych roślinach strączkowych pod koniec sezonu wegetacyjnego, gdy kończy się proces wiązania azotu, czerwony barwnik zmienia się w zielony. Zmiana koloru rozpoczyna się u podstawy guzka, później jego wierzchołek zmienia kolor na zielony. U roślin strączkowych wieloletnich zazielenianie brodawek nie występuje lub obserwuje się je tylko u podstawy brodawki. W różnych typach roślin strączkowych przejście czerwonego pigmentu w zielony zachodzi z różnym stopniem intensywności iw różnym tempie.
Guzki roślin jednorocznych funkcjonują stosunkowo krótko. U większości roślin strączkowych martwica guzków rozpoczyna się w okresie kwitnienia rośliny żywicielskiej i zwykle postępuje od środka do obrzeży guzka. Jedną z pierwszych oznak zniszczenia jest tworzenie się warstwy komórek o potężnych ścianach u podstawy guzka. Ta warstwa komórek, położona prostopadle do głównego naczynia korzenia, oddziela go od brodawki i opóźnia wymianę składników odżywczych między rośliną żywicielską a tkankami brodawki.
W komórkach degenerującej się tkanki guzka pojawiają się liczne wakuole, jądra tracą zdolność do barwienia, część komórek bakterii brodawki ulega lizie, a część migruje do środowiska w postaci małych kokoidalnych komórek artrospore.
Stare guzki są ciemne, zwiotczałe, miękkie. Po przecięciu wystaje z nich wodnisty śluz. Procesowi niszczenia guzków, rozpoczynającym się korkowaniem komórek układu naczyniowego, sprzyja spadek aktywności fotosyntetycznej rośliny, suchość lub nadmierna wilgotność środowiska.
W zniszczonym, śluzowatym guzku często znajdują się pierwotniaki, grzyby, pałeczki i małe bakterie guzkowate.
Stan rośliny żywicielskiej wpływa na czas funkcjonowania guzka. Tak więc, według F. F. Yukhimchuka (1957), kastrując lub usuwając kwiaty łubinu, można wydłużyć okres jego wegetacji i jednocześnie czas aktywnej aktywności bakterii brodawkowych.
Guzki roślin wieloletnich, w przeciwieństwie do guzków jednorocznych, mogą funkcjonować przez wiele lat. Na przykład karagana ma wieloletnie guzki, w których proces starzenia się komórek zachodzi jednocześnie z tworzeniem się nowych. W glicynii (glicynia chińska) funkcjonują również wieloletnie guzki, tworzące kuliste zgrubienia na korzeniach żywiciela. Pod koniec sezonu wegetacyjnego tkanka bakteroidalna guzków wieloletnich ulega degradacji, ale cały guzek nie umiera. W następnym roku zaczyna znowu funkcjonować.
Czynniki warunkujące symbiotyczny związek bakterii brodawkowych z roślinami strączkowymi – do symbiozy zapewniającej dobry rozwój roślin niezbędny jest określony zespół warunków środowiskowych. Jeśli warunki środowiskowe będą niesprzyjające, to nawet pomimo dużej zjadliwości, zdolności konkurencyjnej i aktywności mikrosymbiontu skuteczność symbiozy będzie niska.
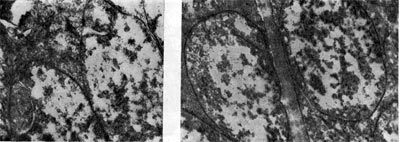
Ryż. 20
Dla rozwoju guzków optymalna wilgotność wynosi 60-70% całkowitej wilgotności gleby. Minimalna wilgotność gleby, przy której możliwy jest jeszcze rozwój bakterii brodawkowych w glebie, wynosi w przybliżeniu 16% całkowitej pojemności wilgoci. Gdy wilgotność jest poniżej tej granicy, bakterie brodawkowe zwykle już się nie namnażają, ale mimo to nie umierają i mogą pozostawać w stanie nieaktywnym przez długi czas. Brak wilgoci prowadzi również do obumierania już uformowanych guzków.
Nadmiar wilgoci, jak również jej brak, jest również niekorzystny dla symbiozy - ze względu na spadek stopnia napowietrzenia w strefie korzeni pogarsza się dopływ tlenu do systemu korzeniowego rośliny. Niewystarczające napowietrzenie negatywnie wpływa również na bakterie brodawkowe żyjące w glebie, które jak wiadomo lepiej się namnażają, gdy dostępny jest tlen. Niemniej jednak wysokie napowietrzenie w strefie korzeniowej prowadzi do tego, że cząsteczkowe reduktory azotu zaczynają wiązać tlen, zmniejszając stopień wiązania azotu w guzkach.
Czynnik temperaturowy odgrywa ważną rolę w związku między bakteriami brodawkowymi a roślinami strączkowymi. Charakterystyki temperaturowe różnych rodzajów roślin strączkowych są różne. Ponadto różne szczepy bakterii brodawkowych mają swoje własne optymalne temperatury dla rozwoju i wiązania aktywnego azotu. Należy zauważyć, że optymalne temperatury dla rozwoju roślin strączkowych, powstawania guzków i wiązania azotu nie pokrywają się. Tak więc w warunkach naturalnych tworzenie się guzków można zaobserwować w temperaturach nieco powyżej 0°C, wiązanie azotu w takich warunkach praktycznie nie zachodzi. Być może tylko arktyczne symbiotyczne rośliny strączkowe wiążą azot w bardzo niskich temperaturach. Zwykle proces ten zachodzi tylko w temperaturze 10°C i wyższej. Maksymalne wiązanie azotu u wielu roślin strączkowych obserwuje się w temperaturze 20-25°C. Temperatury powyżej 30°C niekorzystnie wpływają na proces akumulacji azotu.
Odczyn gleby ma duży wpływ na aktywność życiową bakterii brodawkowych i powstawanie brodawek. Dla różnych gatunków, a nawet szczepów bakterii guzkowych, wartość pH siedliska jest nieco inna. Na przykład bakterie brodawkowe koniczyny są bardziej odporne na niskie wartości pH niż bakterie brodawkowe lucerny. Oczywiście wpływ na to ma również przystosowanie mikroorganizmów do środowiska. Koniczyna rośnie na glebach bardziej kwaśnych niż lucerna. Odczyn gleby jako czynnik ekologiczny wpływa na aktywność i wirulencję bakterii brodawkowych. Najbardziej aktywne szczepy wydają się być łatwiejsze do wyizolowania z gleb o neutralnych wartościach pH. Na glebach kwaśnych częściej występują szczepy nieaktywne i słabo zjadliwe. Kwaśne środowisko (pH 4,0 - 4,5) ma bezpośredni wpływ na rośliny, w szczególności zaburzając syntetyczne procesy metabolizmu roślin i prawidłowy rozwój włośników. W kwaśnym środowisku zaszczepionych roślin okres funkcjonowania tkanki bakteroidalnej jest znacznie skrócony, co prowadzi do zmniejszenia stopnia wiązania azotu.
W glebach kwaśnych, jak zauważył A.V. W Petersburgu do roztworu glebowego przedostają się sole glinu i manganu, niekorzystnie wpływając na rozwój systemu korzeniowego roślin i proces asymilacji azotu, zmniejsza się także zawartość przyswajalnych form fosforu, wapnia, molibdenu i dwutlenku węgla. Niekorzystny odczyn gleby najlepiej niwelować poprzez wapnowanie.
Dla bakterii brodawkowych tkanka żywiciela jest taką pożywką, która może zaspokoić nawet najbardziej wymagający szczep ze względu na zawartość w tkance wszelkiego rodzaju składników odżywczych. Niemniej jednak, po wprowadzeniu bakterii brodawkowych do tkanki rośliny żywicielskiej, ich rozwój determinowany jest nie tylko procesami wewnętrznymi, ale także w dużej mierze zależy od działania czynników zewnętrznych, które wpływają na cały przebieg procesu infekcyjnego. Zawartość lub brak jednego lub drugiego składnika odżywczego w środowisku może być decydującym momentem manifestacji symbiotycznego wiązania azotu.
Stopień zaopatrzenia roślin strączkowych w dostępne formy mineralnych związków azotu decyduje o skuteczności symbiozy. Na podstawie licznych eksperymentów laboratoryjnych i wegetatywnych wiadomo, że im więcej związków zawierających azot w środowisku, tym trudniej bakteriom wniknąć do korzenia.
Duże znaczenie w aktywizacji pobierania azotu przez rośliny strączkowe ma odżywianie fosforem. Przy niskiej zawartości fosforu w pożywce bakterie wnikają do korzenia, ale nie tworzą się guzki. Rośliny strączkowe mają pewne cechy szczególne w wymianie związków zawierających fosfor. Nasiona roślin strączkowych są bogate w fosfor. Fosfor zapasowy podczas kiełkowania nasion nie jest wykorzystywany w taki sam sposób jak w innych uprawach - względnie równomiernie do tworzenia wszystkich organów, ale w większym stopniu skoncentrowany w korzeniach. Dlatego we wczesnych stadiach rozwojowych rośliny strączkowe, w przeciwieństwie do zbóż, w większym stopniu zaspokajają swoje zapotrzebowanie na fosfor kosztem liścieni, a nie rezerw glebowych. Im większe nasiona, tym mniej rośliny strączkowe zależą od fosforu w glebie. Jednak przy symbiotycznym trybie życia zapotrzebowanie na fosfor u roślin strączkowych jest większe niż przy autotroficznym. Dlatego przy braku fosforu w pożywce inokulowanych roślin pogarsza się zaopatrzenie roślin w azot.
Symbiotyczne wiązanie azotu wymaga również magnezu, siarki i żelaza. Przy braku magnezu rozmnażanie się bakterii guzkowych jest zahamowane, zmniejsza się ich aktywność życiowa i hamuje symbiotyczne wiązanie azotu. Siarka i żelazo mają również korzystny wpływ na powstawanie guzków i proces wiązania azotu, w szczególności odgrywają niewątpliwą rolę w syntezie leghemoglobiny.
Spośród pierwiastków śladowych szczególnie zwracamy uwagę na rolę molibdenu i boru. Przy braku molibdenu guzki są słabo uformowane, zaburzona jest w nich synteza wolnych aminokwasów, a synteza leghemoglobiny jest stłumiona. Molibden wraz z innymi pierwiastkami o zmiennej wartościowości (Fe, Co, Cu) pośredniczy w przenoszeniu elektronów w enzymatycznych reakcjach redoks. Przy niedoborze boru w guzkach nie tworzą się wiązki naczyniowe, w wyniku czego rozwój tkanki bakterioidalnej zostaje zakłócony.
Na tworzenie się guzków w roślinach strączkowych duży wpływ ma metabolizm węglowodanów roślin, który determinowany jest przez szereg czynników: fotosyntezę, obecność dwutlenku węgla w środowisku oraz cechy fizjologiczne roślin. Poprawa żywienia węglowodanowego pozytywnie wpływa na proces inokulacji i akumulację azotu. Z praktycznego punktu widzenia bardzo interesujące jest wykorzystanie słomy i świeżego obornika do nawożenia roślin strączkowych jako źródła węglowodanów. Ale w pierwszym roku po wprowadzeniu słomy do gleby podczas jej rozkładu gromadzą się toksyczne substancje. Należy zauważyć, że nie wszystkie rodzaje roślin strączkowych są wrażliwe na toksyczne produkty rozkładu słomy; na przykład groszek nie reaguje na nie.
