Zgodność ze środkami aseptycznymi jest stosowanie sterylnego sprzętu i roztworów oraz zapobieganie ich kontaminacji podczas pracy. Bakterie i zarodniki grzybów są szeroko rozpowszechnione w środowisku, w tym w laboratoriach. Mikrobiolodzy muszą stale dbać o sterylność pożywki hodowlanej i sprzętu. Te „niedogodności” są nieodłączną częścią pracy każdego mikrobiologa. Szkolne i uniwersyteckie laboratoria uczą jedynie podstawowych środków ostrożności. Rutynowa praca mikrobiologiczna wymaga specjalnie wyposażonych laboratoriów. Powinny posiadać powierzchnie łatwe do utrzymania w czystości oraz specjalnie odgrodzone miejsca pracy (boksy), do których dostarczane jest przefiltrowane, sterylne powietrze.
Napełnianie kubków
Napełnianie kubków jedna z podstawowych metod mikrobiologicznych. Szalka to szalka Petriego zawierająca agar odżywczy. Szalki Petriego to specjalnie wykonane płytkie okrągłe pojemniki, które mogą być szklane lub plastikowe. Stosowane są do hodowli bakterii, grzybów lub kultur tkankowych na podłożach stałych. Zazwyczaj szalki Petriego mają średnicę około 9 cm. Szklane kubki mogą być ponownie użyte po sterylizacji w autoklawie. Plastikowe kubki są wyrzucane po użyciu; są zwykle autoklawowane w celu zniszczenia kultury. Jednocześnie topią się. Kubki kupowane są w zapieczętowanych opakowaniach, które są sterylizowane promieniowaniem gamma. Pokrywki zapobiegają zanieczyszczeniu kubka, jednak cząsteczki gazu mogą dyfundować między wewnętrzną objętością kubka a otoczeniem poprzez mikroskopijne nieregularności w punktach styku dna z wieczkiem. Dzięki temu tlen ma dostęp do kultury, a dwutlenek węgla jest usuwany na zewnątrz.
Procedura zalewania stopiony agar odżywczy („wypełnianie szalki”) pokazano na rysunku. Rozumie się, że agar przygotowano w małych fiolkach (fiolki McCartneya).
Metody inokulacji
Przy wprowadzaniu niewielkiej liczby mikroorganizmów do pożywki hodowlanej - inokulacji (lub wysiewaniu) - konieczne jest stosowanie metod aseptycznych, aby uniknąć kontaminacji.
Procedury inokulacji różnią się w zależności od rodzaju podłoża (płynne lub stałe).
Wysiew na podłożu stałym
Siew uderzeniowy lub siew rozcieńczony
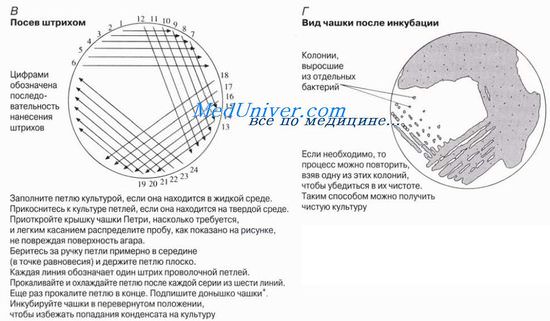
Metoda jest pokazana na rysunku. Służy do izolowania czystych kolonii bakteryjnych z mieszaniny bakterii. Do siewu stosuje się drucianą pętlę, którą należy najpierw zapalić, jak pokazano na ryc. 12.4,L do sterylizacji. Następnie za pomocą ezy pobiera się cienką warstewkę płynnej zawiesiny lub niewielką ilość materiału stałego zawierającego badany mikroorganizm z uprzednio wyhodowanej kultury lub innego źródła mikroorganizmu. Pętlę delikatnie przesuwa się po powierzchni podłoża, wykonując serię pociągnięć. Po każdej serii pociągnięć kubeczek jest lekko obracany, tak aby bakterie z poprzedniej serii pociągnięć były rozprowadzane w każdej nowej serii, zmniejszając w ten sposób liczbę pociągnięć do poszczególnych bakterii. (Nie spodziewaj się, że zobaczysz coś na ostatnich pociągnięciach przed upływem czasu inkubacji!) Kiedy metoda jest praktykowana, pociągnięcia można wykonać bardzo szybko.
Dzięki tej metodzie bakterie można izolować z naturalnych siedlisk, takich jak gleba, mleko, woda. Próbki substancji stałych, takich jak gleba, najlepiej zawiesić w niewielkiej ilości wody lub wstępnie inkubować w płynnym podłożu. Bezpiecznym źródłem rutynowej pracy jest mleko pasteryzowane. Przed eksperymentowaniem z bakteriami lub grzybami zapoznaj się z instrukcją i zasadami bezpieczeństwa, aby zminimalizować ryzyko wyhodowania szkodników.
Wysiewanie na powierzchni agaru
Ta metoda jest zilustrowana na rysunku. Jest wygodny do inokulacji mikroorganizmów z płynnej zawiesiny na pożywkę stałą. Metodę stosuje się do określenia liczby żywych komórek w próbce po seryjnych rozcieńczeniach. Można go również stosować do uzyskania ciągłego „trawnika” mikroorganizmów na powierzchni agaru po gęstym zaszczepieniu. Jest to przydatne przy analizie działania inhibitorów, takich jak antybiotyki czy środki dezynfekujące, które dodaje się do dołków wykonanych w agarze lub nakłada na krążki bibuły filtracyjnej umieszczone na powierzchni agaru. Inhibitor dyfunduje przez agar, tworząc strefę zahamowania wzrostu wokół otworów lub krążków bibuły filtracyjnej, co jest widoczne po inkubacji. Średnica strefy może służyć jako miara stopnia hamowania.
Siew przez wylewanie
Siew przez wylewanie metoda alternatywna do metody wysiewu powierzchniowego agaru jest stosowana do inokulacji komórek z hodowli płynnej, jak również do liczenia żywych komórek. Ponieważ komórki są rozmieszczone w całym podłożu, a nie tylko na powierzchni agaru, można policzyć ich znacznie więcej – do 1000 kolonii na płytce. Jednak wielkość wyhodowanych kolonii jest znacznie mniejsza.
Określona objętość(do 0,5 cm 3) zawiesiny komórek wprowadza się do odpowiedniej objętości (około 15-20 cm 3) wysterylizowanego agaru odżywczego roztopionego w małej fiolce, którą wcześniej schłodzono do 45-50°C w łaźni wodnej. Zdjąć nakrętkę i wypalić szyjkę fiolki przed dodaniem zawiesiny komórek, jak pokazano na rysunku. Zawiesinę komórek dokładnie miesza się z agarem odżywczym, obracając (nie potrząsając) fiolką trzymaną w dłoniach w przód iw tył. Następnie wlej mieszaninę do sterylnej szalki Petriego, jak pokazano na rysunku. Podpisz dno szalki i inkubuj je. Po inkubacji naczynie wygląda jak na zdjęciu.
Siew przez iniekcję
metoda stosowany do hodowli organizmów beztlenowych lub organizmów rosnących przy niskim stężeniu tlenu (mikroaerofile). Zwykle używa się probówki z pożywką agarową. Ze względu na małą powierzchnię i dość dużą głębokość agaru w probówce w porównaniu z szalką, dostęp tlenu do wnętrza agaru jest ograniczony. Wysiew odbywa się drutem prostym (bez pętli) lub igłą bakteriologiczną. Niewielką ilość kultury (stałej lub płynnej) pobiera się czubkiem igły, a następnie pionowo nakłuwa się nią agar. Kultura rośnie na agarze we wszystkich kierunkach od linii nakłucia.
