№ 43 שיטות לקביעת רגישות החיידקים לאנטיביוטיקה.
כדי לקבוע את רגישות החיידקים לאנטיביוטיקה (אנטיביוגרמות)משמש בדרך כלל:
שיטת דיפוזיהלתוך אגר .
החיידק הנחקר מחוסן על מדיום תזונתי אגר, ולאחר מכן מוסיפים אנטיביוטיקה. בדרך כלל, תרופות מוחלות או על בארות מיוחדות באגר, או דיסקים עם אנטיביוטיקה מונחים על פני הזרע ("שיטת הדיסק"). התוצאות מתועדות ביום על ידי נוכחות או היעדר גידול מיקרוביאלי סביב החורים (דיסקים). שיטת דיסק - איכותית
ומאפשרת להעריך האם החיידק רגיש או עמיד לתרופה.
שיטות קביעה
ריכוזים מינימליים מעכבים וקוטלי חיידקים, כלומר הרמה המינימלית של אנטיביוטיקה המאפשרת במבחנה למנוע גידול חיידקי גלוי במצע התרבות או לעקר אותו לחלוטין. זֶה כמותישיטות המאפשרות לך לחשב את מינון התרופה, שכן ריכוז האנטיביוטיקה בדם חייב להיות גבוה משמעותית מהריכוז המעכב המינימלי עבור הגורם הזיהומי. מתן מינונים נאותיםהתרופה נחוצה עבור טיפול יעילומניעת היווצרות חיידקים עמידים.
לאכול דרכים מואצות, באמצעות מנתחים אוטומטיים.
קביעת רגישות החיידקים לאנטיביוטיקה בשיטת הדיסק.
תרבית החיידקים הנחקרת נזרעת עם דשא על אגר מזין או מדיום AGV בצלחת פטרי.
מדיום AGV: מרק דגים מזין יבש, אגר-אגר, נתרן פוספט די-בסיסי. את המדיום מכינים מאבקה יבשה בהתאם להוראות.
דיסקיות נייר המכילות מנות מסוימות של אנטיביוטיקה שונות מונחות על משטח הזרע עם פינצטה באותו מרחק זה מזה. גידולים מודגרים ב-37 מעלות צלזיוסלפני היום הבא. על פי קוטר אזורי עיכוב הגדילה של תרבית החיידקים הנחקרת, נשפטת רגישותו לאנטיביוטיקה.
בשביל לקבל תוצאות אמינותיש צורך להשתמש בדיסקים סטנדרטיים ובמדיה תזונתית, לשליטה בהם משתמשים בזני התייחסות של המיקרואורגניזמים המתאימים. שיטת הדיסק אינה מספקת נתונים מהימנים לקביעת רגישותם של מיקרואורגניזמים לאנטיביוטיקה פוליפפטידית המתפזרת בצורה גרועה לאגר (לדוגמה, polymyxin, ristomycin). אם יש להשתמש באנטיביוטיקה זו לטיפול, מומלץ לקבוע את הרגישות של מיקרואורגניזמים בשיטת דילול סדרתי.
קביעת רגישות החיידקים לאנטיביוטיקה בשיטת דילול סדרתי.
שיטה זו קובעת את הריכוז המינימלי של האנטיביוטיקה המעכבת את הצמיחה של תרבית החיידקים הנחקרת. ראשית, הכינו תמיסה המכילה ריכוז מסוים של האנטיביוטיקה (מק"ג/מ"ל או ED/ml) בממס מיוחד או בתמיסת חיץ. מכינים ממנו את כל הדילולים הבאים במרק (בנפח של 1 מ"ל), ולאחר מכן מוסיפים לכל דילול 0.1 מ"ל של תרחיף החיידקים הנחקר המכיל 10 6 -10 7 תאי חיידקים לכל 1 מ"ל. הוסף 1 מ"ל של מרק ו-0.1 מ"ל של תרחיף חיידקים לצינור האחרון (בקרת תרבות). החיסונים מודגרים ב-37 מעלות צלזיוס עד למחרת, ולאחר מכן מצוינות תוצאות הניסוי על עכירות המדיום התזונתי, בהשוואה לבקרת התרבית. הצינור האחרון עם מצע תזונתי שקוף מעיד על עיכוב בגדילה של תרבית החיידקים הנחקרת, בהשפעת הריכוז המעכב המינימלי (MIC) של האנטיביוטיקה הכלולה בה.
הערכת תוצאות קביעת הרגישות של מיקרואורגניזמים לאנטיביוטיקה מתבצעת על פי טבלה מוכנה מיוחדת, המכילה את ערכי הגבול של קטרים של אזורי עיכוב גדילה עבור זנים עמידים, עמידים בינונית ורגישים, כמו גם ערכי MIC של אנטיביוטיקה עבור זנים עמידים ורגישים.
זנים רגישיםמיקרואורגניזמים שצמיחתם מעוכבת בריכוזי התרופה המצויים בסרום הדם של המטופל בעת שימוש במינונים רגילים של אנטיביוטיקה.הזנים העמידים במידה בינונית הם, לדיכוי גדילתו נדרשים הריכוזים הנוצרים בסרום הדם במתן מינונים מקסימלייםתְרוּפָה. מיקרואורגניזמים עמידים, שצמיחתו אינה מדוכאת על ידי התרופה בריכוזים שנוצרים בגוף בעת שימוש במקסימום מינונים מותרים.
קביעת אנטיביוטיקה בדם, שתן ונוזלי גוף אחרים.
שתי שורות של מבחנות מונחות במדף. באחד מהם מכינים דילולים של האנטיביוטיקה הייחוס, בשנייה, נוזל הבדיקה.לאחר מכן, תרחיף של חיידקי בדיקה שהוכנו במדיום Hiss עם גלוקוז מתווסף לכל מבחנה. בעת קביעת פניצילין, טטרציקלינים, אריתרומיצין בנוזל הבדיקה, זן סטנדרטי S משמש כחיידקי בדיקה. aureus, ובעת קביעת סטרפטומיצין - E. coli . לאחר דגירה של יבולים ב-37 מעלות צלזיוסתוך 18-20 שעות מצוינות תוצאות הניסוי על עכירות המדיום והצביעה שלו עם אינדיקטור עקב פירוק הגלוקוז על ידי חיידקי הבדיקה. ריכוז האנטיביוטיקה נקבע על ידי הכפלת הדילול הגבוה ביותר של נוזל הבדיקה המעכב את גדילת חיידקי הבדיקה בריכוז המינימלי של אנטיביוטיקה הייחוס המעכבת את הצמיחה של אותם חיידקי בדיקה. לדוגמה, אם הדילול המקסימלי של נוזל הבדיקה המעכב את צמיחת חיידקי הבדיקה הוא 1:1024, והריכוז המינימלי של אנטיביוטיקה הייחוס המעכב את הצמיחה של אותם חיידקי בדיקה הוא 0.313 מיקרוגרם/מ"ל, אזי התוצר של 1024x0.313=320 מיקרוגרם/מ"ל הוא אנטיביוטיקה בריכוז ב-1 מ"ל.
הגדרת יכולת
ס.אוראוס לייצר בטא-לקטמאז.
בבקבוק עם 0.5 מ"ל של תרבית מרק יומית של זן סטנדרטי של סטפילוקוקוס הרגיש לפניצילין, הוסף 20 מ"ל מותך ומקורר ל-45 מעלות צלזיוס.אגר תזונתי, מערבבים ויוצקים לצלחת פטרי. לאחר שהאגר התמצק, מניחים דיסקית המכילה פניצילין במרכז הכלי על פני המדיום. התרבויות הנלמדות נזרעות לאורך רדיוסי הדיסק עם לולאה. החיסונים מודגרים ב-37 מעלות צלזיוס עד למחרת, ולאחר מכן מצוינות תוצאות הניסוי. יכולתם של החיידקים הנחקרים לייצר בטא-לקטמאז נשפטת על פי נוכחות של גידול של זן סטנדרטי של סטפילוקוקוס סביב אחת או אחרת מהתרבית הנחקרת (מסביב לדיסק).
(לפי צו משרד הבריאות של ברית המועצות מס' 250 מיום 13 במרץ 1975, "על איחוד שיטות לקביעת רגישות מיקרואורגניזמים לתרופות כימותרפיות".)
IN פרקטיקה קליניתמיקרואורגניזמים שעליהם יש לאנטיביוטיקה השפעה בקטריוסטטית או חיידקית נחשבים רגישים לאנטיביוטיקה.
לכל מחקר מעבדההקריטריון לרגישות של מיקרואורגניזמים לאנטיביוטיקה הוא הריכוז המינימלי של אנטיביוטיקה המעכב (מעכב) את הצמיחה של הגורם הגורם למחלה כאשר תנאים סטנדרטייםהגדרת החוויה.
כדי לקבוע רגישות לתרופה, עדיף להשתמש בתרבית טהורה של הפתוגן. יש צורך לבודד תרביות של חיידקים מהגוף לצורך בדיקת רגישות לפני התחלת טיפול אנטיביוטי, שכן בהשפעתם ניתן לעכב לחלוטין את הצמיחה של הגורם הגורם למחלה. הרגישות של מיקרואורגניזמים לאנטיביוטיקה נקבעת על ידי דיפוזיה לתוך אגר באמצעות דיסקים סטנדרטיים או על ידי דילול סדרתי במדיות תזונתיות נוזליות ומוצקות.
שיטות קביעה
שיטת דיסק. השעיה של התרבות הנחקרת נזרעת עם "מדשאה" (ראה פרק 7). כמו חיסון, ניתן להשתמש בתרבית מרק יומית או 1 מיליארד תרחיף מיקרוביאלי שהוכן לפי התקן האופטי של עכירות מס' 10 (ראה להלן). כוסות הזרע מייבשים במשך 30-40 דקות בשעה טמפרטורת חדר. לאחר מכן מניחים דיסקים מנייר ספוגים בתמיסות של אנטיביוטיקה שונות על פני השטח של אגר זרע עם פינצטה. כל דיסק נלחץ קלות עם הלסתות של הפינצטה, כך שייכנס היטב אל פני השטח של האגר. הדיסקים מונחים במרחקים שווים זה מזה ובמרחק של 2 ס"מ מקצה הכוס. ניתן להשתמש בצלחת אחת כדי לחקור את הרגישות של זן אחד ל-4-5 אנטיביוטיקה.
כוסות הזרעים עם הדיסקים המוחלים עליהן מונחות בתרמוסטט בטמפרטורה של 37 מעלות צלזיוס למשך 18-24 שעות. הכוסות מונחות הפוך כדי למנוע מי עיבוי על פני השטח של הגידולים.
התחשבנות בתוצאות. פעולת האנטיביוטיקה מוערכת על ידי התופעה של פיגור גדילה סביב הדיסק (איור 25). הקוטר של אזורי עיכוב הצמיחה של החיידקים סביב הדיסקים נקבע באמצעות סרגל, כולל קוטר הדיסק עצמו. בין מידת הרגישות של החיידק לאנטיביוטיקה לבין גודל אזור אי הגדילה, יש את הקשרים הבאים (טבלה 10).
אורז. 25. קביעת רגישות החיידקים לאנטיביוטיקה (שיטת דיסק)
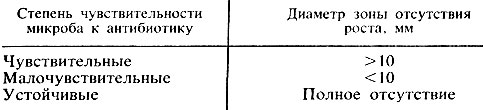
טבלה 10. קביעת מידת הרגישות של מיקרואורגניזמים לאנטיביוטיקה לפי גודל האזור ללא צמיחה
התשובה מציינת איזו רגישות יש לזן הנחקר, ולא את גודל אזור עיכוב הגדילה.
במקרים מסוימים, לקבוע את הרגישות של מיקרואורגניזמים לאנטיביוטיקה בחומר המקומי (מוגלה, הפרשת פצעים וכו '). במקרה זה, החומר מוחל על פני השטח של אגר מזין ומשפשף באופן שווה על פני השטח עם מרית זכוכית סטרילית *, ולאחר מכן מוחלים דיסקים. שיטת הדיסק לקביעת רגישותם של מיקרואורגניזמים בשל פשטותה ונגישותה נמצאת בשימוש נרחב במעבדות מעשיות ונחשבת כשיטה איכותית.
* (עבור סוגי מיקרואורגניזמים אלה שאינם גדלים על אגר בשר פפטון, כגון סטרפטוקוקוס, פנאומוקוק ואחרים, משתמשים באגר עם דם או סרום.)
שיטת דילול סדרתי במדיום תזונתי נוזלי. שיטה זו היא שיטה כמותית מדויקת, היא משמשת ב עבודה מדעיתובמקרים חשובים במיוחד במעבדות בתי חולים ומוסדות מניעה.
כדי להגדיר ניסוי, אתה חייב תרבות טהורהשל המיקרואורגניזם שנבדק, התמיסה העיקרית של האנטיביוטיקה, מרק הבשר-פפטון על העיכול של Hottinger, המכיל 1.2-1.4 גרם/ליטר של חנקן אמין.
פעילות האנטיביוטיקה מתבטאת ביחידות/מ"ל או מק"ג/מ"ל. להכנת תמיסת המניות של האנטיביוטיקה, נעשה שימוש באנטיביוטיקה הזמינה מסחרית עם ציון מספרן בבקבוקון.
אם על התווית, במקום מספר היחידות בבקבוקון, המינון מצוין ביחידות מסה, יש לזכור ש-1 גרם של פעילות עבור רוב האנטיביוטיקה מתאים ל-1 מיליון יחידות. מתמיסה זו יש להכין את הדילולים הנדרשים של אנטיביוטיקה. הנחיות להכנת תמיסה של אנטיביוטיקה באמצעות פניצילין כדוגמה ניתנות בטבלה. אחד עשר.
טבלה 11 הכנת תמיסת מניות פניצילין
מכינים תרחיף של תרבית של מיקרואורגניזמים הגדלים על מצע מזין צפוף. התרחיף שנוצר מושווה לתקן עכירות אופטית מס' 10 (ראה להלן), ולאחר מכן מדולל בסטרילי מי מלח איזוטונינתרן כלורי עד 10 6 גופים מיקרוביאליים ב-1 מ"ל. כדי להשיג את הדילול המתאים של התרחיף המיקרוביאלי, מכינים סדרה של דילולים רצופים של פי עשרה (ראה להלן).
הגדרת החוויה. ב-12 מבחנות סטריליות יוצקים 1 מ"ל של תווך תזונתי נוזלי. במבחנה הראשונה מוסיפים 1 מ"ל מתמיסת המניות של האנטיביוטיקה המכילה, למשל, 32 IU ל-1 מ"ל. מערבבים את תכולת השפופרת ה-1 ומעבירים 1 מ"ל לצינור השני, מהשני ל-3, מה-3 ל-4, וכן הלאה עד ה-10, שממנו מסירים 1 מ"ל. לפיכך, הצינור הראשון יכיל 16 יחידות, השני - 8 יחידות, ה-3 - 4 יחידות וכו'. פיפטה נפרדת משמשת להכנת כל דילול. תכולת הצינורית ה-11 משמשת בקרה לגידול חיידקים, והצינור ה-12 משמש בקרה לסטריליות המדיום התזונתי. לכל המבחנות, למעט ה-12, הוסף 0.1 מ"ל של תרבית הבדיקה בצפיפות מסוימת. את החיסון מדגרים בתרמוסטט למשך 18-24 שעות ורושמים את תוצאות הניסוי.
התוצאות נרשמות בנוכחות גידול בבקרת התרבית והיעדר צמיחה בבקרת המדיום. לאחר מכן שימו לב לצינור האחרון עם עיכוב צמיחה גלוי לחלוטין של חיידקים. כמות האנטיביוטיקה בצינור זה היא הריכוז המעכב המינימלי לזן הנבדק וקובעת את מידת הרגישות שלו ל האנטיביוטיקה הזו. התגובה שהוציאה המעבדה מציינת את הריכוז המינימלי המעכב.
שיטה של דילול סדרתי על מדיום תזונתי מוצק. הכינו דילולים כפולים של האנטיביוטיקה, כמו בשיטת דילול סדרתי במצע תזונתי נוזלי. לאחר מכן קח חלק אחד מכל דילול אנטיביוטיקה ו-9 חלקים של אגר תזונתי, מומס ומקורר ל-42 מעלות צלזיוס (בשיעור של 1 מ"ל אנטיביוטיקה + 9 מ"ל של MPA), מערבבים היטב ויוצקים לצלחות פטרי.
הצפיפות (ריכוז) התרבית נקבעת לפי תקן עכירות אופטית מס' 10 ומדללת בתמיסה איזוטונית סטרילית ל-10 7 גופים מיקרוביאליים ב-1 מ"ל. את תרביות הבדיקה מורחים עם לולאה חיידקית על פני השטח של אגר תזונתי עם אנטיביוטיקה. 20-25 זנים מחוסנים לכל כוס. כוסות זרע ממוקמות בתרמוסטט ב-37 מעלות צלזיוס למשך 16-20 שעות עבור רוב סוגי המיקרואורגניזמים. צלחת האגר התזונתית ללא אנטיביוטיקה, עליה מורחים את תרביות הבדיקה, היא הבקרה.
התוצאות מתועדות בנוכחות גידול בצלחת הבקרה, והריכוז המעכב המינימלי של האנטיביוטיקה נקבע על ידי צלחת הפטרי האחרונה, שבה מצוין עיכוב מוחלט בגידול החיידקים.
שיטת המסלול של פלמינג. השיטה משמשת לקביעת ספקטרום הפעולה של אנטיביוטיקה. בצלחת פטרי עם MPA גוזרים שביל ברוחב 1 ס"מ בעזרת אזמל סטרילי ומוציאים אותו. לאחר מכן, ריכוז מסוים של תמיסת אנטיביוטיקה מוכנס למבחנה עם אגר בשר פפטון מומס ומקורר ל-42-45 מעלות צלזיוס. את תכולת השפופרת מערבבים ושופכים למסלול כדי שהנוזל לא יחרוג מגבולותיו. לאחר התמצקות האגר, תרביות של מספר מיקרואורגניזמים שנחקרו מחוסנות עם לולאה בניצב לנתיב. גידולים ממוקמים בתרמוסטט למשך 18-24 שעות.
שיטות לקביעת רגישות החיידקים לאנטיביוטיקה מחולקות ל-2 קבוצות: שיטות דיפוזיה ודילול.
קביעת רגישות החיידקים לאנטיביוטיקה:
שיטות דיפוזיה
באמצעות דיסקים אנטיביוטיים
באמצעות בדיקות אלקטרוניות
שיטות רבייה
רבייה במצע תזונתי נוזלי (מרק)
רבייה באגר
בבדיקת רגישות לדיפוזיה, תרחיף חיידקי בצפיפות ספציפית (בדרך כלל שווה ערך לתקן עכירות מקפרלנד של 0.5) מוחל על פני האגר בצלחת פטרי, ולאחר מכן מניחים דיסקים המכילים כמות מסוימת של אנטיביוטיקה. פיזור האנטיביוטיקה לתוך האגר מוביל להיווצרות אזור של עיכוב צמיחת מיקרואורגניזמים סביב הדיסקים. לאחר דגירה של הכלים בתרמוסטט בטמפרטורה של 35o-37oC למשך הלילה, התוצאה נלקחת בחשבון על ידי מדידת קוטר האזור סביב הדיסק במילימטרים (איור 1).
איור 1. קביעת הרגישות של מיקרואורגניזמים בשיטת דיפוזיה בדיסק.
קביעת הרגישות של מיקרואורגניזם באמצעות מבחן E מתבצעת בדומה לבדיקה בשיטת הדיפוזיה בדיסק. ההבדל הוא שבמקום דיסק עם אנטיביוטיקה, נעשה שימוש ברצועת E-test המכיל שיפוע של ריכוזי אנטיביוטיקה ממקסימום למינימום (איור 2). בהצטלבות של אזור עיכוב הגדילה האליפטי עם רצועת הבדיקה E, מתקבל ערך ריכוז מעכב מינימלי (MIC).
![]()
איור 2. קביעת הרגישות של מיקרואורגניזמים באמצעות בדיקות E.
היתרון הבלתי מעורער של שיטות דיפוזיה הוא קלות הבדיקה וזמינות הביצועים בכל מעבדה בקטריולוגית. עם זאת, לאור העלות הגבוהה של בדיקות E, שיטת הדיפוזיה של הדיסק משמשת בדרך כלל לעבודה שגרתית.
שיטות הדילול מבוססות על שימוש בדילול סדרתי כפול של ריכוזי אנטיביוטיקה ממקסימום למינימום (לדוגמה, מ-128 מיקרוגרם/מ"ל, 64 מיקרוגרם/מ"ל וכו' ל-0.5 מיקרוגרם/מ"ל, 0.25 מיקרוגרם/מ"ל ו-0.125 מיקרוגרם/מ"ל. ).ml). במקרה זה, האנטיביוטיקה בריכוזים שונים מוכנסת למצע תזונתי נוזלי (מרק) או לאגר. לאחר מכן, תרחיף חיידקים בצפיפות מוגדרת, המתאים לתקן עכירות מקפרלנד של 0.5, מונח במרק האנטיביוטי או על גבי צלחת האגר. לאחר דגירה לילה בטמפרטורה של 35o-37oC, התוצאות שהתקבלו נרשמות. נוכחות של גידול מיקרואורגניזמים במרק (עננות של המרק) או על פני האגר מצביעה על כך שריכוז זה של האנטיביוטיקה אינו מספיק כדי לדכא את הכדאיות שלה. ככל שריכוז האנטיביוטיקה עולה, הצמיחה של המיקרואורגניזם מתדרדרת. הריכוז האנטיביוטי הראשון הנמוך ביותר (מסדרה של דילולים סדרתיים), שבו גידול חיידקים אינו נקבע חזותית, נחשב לריכוז המעכב המינימלי (MIC). ה-MIC נמדד ב-mg/l או µg/ml (איור 3).

איור 3. קביעת ערך ה-MIC בשיטת דילול במדיום מזין נוזלי.
71. עקרונות של טיפול אנטיביוטי רציונלי.
מניעת התפתחות של סיבוכים מורכבת, קודם כל, בהתאם עקרונות של טיפול אנטיביוטי רציונלי(כימותרפיה אנטי-מיקרוביאלית):
עקרונות מיקרוביולוגיים.לפני רישום התרופה, יש צורך לקבוע גורם מדבק ולהגדיר את זה רגישות אישית לתרופות כימותרפיות אנטי-מיקרוביאליות. על פי תוצאות האנטיביוגרמה, למטופל רושמים את התרופה לְצַמְצֵםספקטרום הפעולה, בעל הפעילות הבולטת ביותר נגד פתוגן ספציפי, במינון גבוה פי 2-3 מהריכוז המעכב המינימלי. אם הגורם הסיבתי עדיין לא ידוע, אז בדרך כלל נרשמות תרופות בספקטרום רחב יותר, הפעילות נגד כל החיידקים האפשריים שגורמים לרוב. הפתולוגיה הזו. תיקון הטיפול מתבצע תוך התחשבות בתוצאות של בדיקה בקטריולוגית וקביעת הרגישות האישית של פתוגן מסוים (בדרך כלל לאחר 2-3 ימים). יש צורך להתחיל טיפול בזיהום מוקדם ככל האפשר (ראשית, בתחילת המחלה יש פחות חיידקים בגוף, ושנית, התרופות פעילות יותר על גידול והתרבות של חיידקים).
עקרון פרמקולוגי.לָקַחַת בְּחֶשְׁבּוֹן תכונות סמים - הפרמקוקינטיקה והפרמקודינמיקה שלו, הפצה בגוף, תדירות המתן, אפשרות לשילוב תרופות וכו'. מינונים של תרופות צריכים להספיק כדי להבטיח ריכוזים מיקרובוסטטיים או מיקרוביצידיים בנוזלים וברקמות ביולוגיות. נדרש משך הטיפול האופטימלי , כיוון ששיפור קליני אינו סיבה להפסקת התרופה, כי עלולים להימשך פתוגנים בגוף וייתכן חזרתה של המחלה. קחו בחשבון גם דרכי מתן אופטימליות תרופה, שכן אנטיביוטיקה רבות נספגות בצורה גרועה ממערכת העיכול או אינן חודרות את מחסום הדם-מוח.
עקרון קליני.כאשר רושמים תרופה, שקול עד כמה היא בטוחה עבור מטופל נתון, אשר תלוי במאפיינים האישיים של מצבו של המטופל (חומרת הזיהום, מצב חיסונימין, הריון, גיל, תפקודי כבד וכליות, מחלות נלוותוכו') במקרה של חמור, מסכן חייםזיהומים, טיפול אנטיביוטי בזמן הוא בעל חשיבות מיוחדת. חולים כאלה נקבעים שילובים של שתיים או שלוש תרופות כדי להבטיח את ספקטרום הפעולה הרחב ביותר האפשרי. כאשר רושמים שילוב של מספר תרופות, יש לדעת עד כמה השילוב של תרופות אלו יהיה יעיל כנגד הפתוגן ועד כמה בטוח למטופל, כלומר, כך שלא יהיה אנטגוניזם תרופותביחס לפעילות אנטיבקטריאלית ולא היה סיכום של השפעותיהם הרעילות.
עקרון אפידמיולוגי.יש לקחת בחשבון את בחירת התרופה, במיוחד עבור המאושפז מצב עמידות של זנים מיקרוביאלייםמַחזוֹרִי במחלקה הזו, בבית החולים ואפילו באזור. יש לזכור כי לא רק ניתן לרכוש עמידות לאנטיביוטיקה, אלא גם לאבד, בעוד הרגישות הטבעית של המיקרואורגניזם לתרופה משוחזרת. רק היציבות הטבעית לא משתנה.
עקרונות פרמצבטיים.יש לשקול תאריך אחרון לשימושוכבוד כללי אחסוןתרופה, שכן אם כללים אלה מופרים, האנטיביוטיקה יכולה לא רק לאבד את פעילותה, אלא גם להיות רעילה עקב השפלה. חשוב גם מחירתְרוּפָה.
71. עמידות לתרופות של מיקרואורגניזמים ומנגנון התרחשותה. הרעיון של זני בית חולים של מיקרואורגניזמים. דרכים להתגבר על עמידות לתרופות.
עמידות לאנטיביוטיקה היא עמידות של חיידקים לתרופות כימותרפיות אנטי-מיקרוביאליות. חיידקים צריכים להיחשב עמידים אם הם אינם מנוטרלים על ידי ריכוזי תרופות כאלה שנוצרים בפועל במקרואורגניזם. התנגדות יכולה להיות טבעית ונרכשת.
קיימות טבעית. מינים מסוימים של חיידקים עמידים באופן טבעי למשפחות מסוימות של אנטיביוטיקה, או כתוצאה מהיעדר מטרה מתאימה (לדוגמה, למיקופלזמות אין דופן תא, ולכן אינו רגיש לכל התרופות הפועלות ברמה זו), או כתוצאה מאטימות חיידקים ל התרופה הזו(לדוגמה, חיידקים גרם שליליים פחות חדירים לתרכובות מולקולריות גדולות מאשר חיידקים גרם חיוביים, מכיוון שהם קרום חיצוניבעל נקבוביות "קטנות").
התנגדות נרכשת. רכישת עמידות היא דפוס ביולוגי הקשור להסתגלות של מיקרואורגניזמים לתנאי הסביבה.
בסיס גנטי של התנגדות נרכשת. עמידות לאנטיביוטיקה נקבעת ומתוחזקת על ידי גנים עמידות (ר-גנים) והתנאים המקדמים את התפשטותם באוכלוסיות מיקרוביאליות. עמידות לתרופות נרכשת יכולה להתעורר ולהתפשט באוכלוסיית חיידקים כתוצאה מ:
מוטציות בכרומוזום תא חיידקיואחריו בחירה (כלומר בחירה) של מוטנטים.הבחירה קלה במיוחד בנוכחות אנטיביוטיקה, שכן בתנאים אלו המוטנטים זוכים ליתרון על פני תאים אחרים באוכלוסיה הרגישים לתרופה. מוטציות מתרחשות ללא קשר לשימוש באנטיביוטיקה, כלומר התרופה עצמה אינה משפיעה על תדירות המוטציות ואינה הגורם להן, אלא משמשת כגורם סלקציה. יתר על כן, תאים עמידים מולידים וניתן להעבירם לגופו של המארח הבא (אדם או בעל חיים), ליצור ולהפיץ זנים עמידים. מוטציות יכולות להיות: 1) בודדות (אם המוטציה התרחשה בתא אחד, שכתוצאה ממנה מסונתזים בו חלבונים שהשתנו) ו-2) מרובות (סדרה של מוטציות, כתוצאה מכך לא אחת, אלא קבוצה שלמה של חלבונים משנים, למשל, חלבונים קושרים פניצילין בפנאומוקוקוס עמיד בפניצילין);
העברה של פלסמידים ניתנים להעברה (R-plasmids).פלסמידים עמידות (ניתנים להעברה) מקודדים בדרך כלל עמידות צולבת למספר משפחות של אנטיביוטיקה. בפעם הראשונה, התנגדות מרובה כזו תוארה על ידי חוקרים יפנים ביחס ל חיידקי מעיים. כעת הוכח שהוא מופיע בקבוצות אחרות של חיידקים. חלק מהפלסמידים יכולים לעבור בין חיידקים סוגים שוניםלפיכך, ניתן למצוא את אותו גן עמידות בחיידקים המרוחקים זה מזה מבחינה טקסונומית. לדוגמה, בטא-לקטמאז, המקודד על ידי פלסמיד TEM-1, מופץ באופן נרחב בחיידקים גרם-שליליים ומופיע ב-Escherichia coli ובחיידקי מעיים אחרים, כמו גם בגונוקוקוס עמיד בפניצילין וב-Haemophilus influenzae עמיד לאמפיצילין;
העברת טרנספוזונים הנושאים גנים r(או נדידה של רצפים גנטיים). טרנספוזונים יכולים לנדוד מכרומוזום לפלסמיד ולהיפך, כמו גם מפלסמיד לפלסמיד אחר. כך, גנים של עמידות יכולים לעבור לתאי בת או על ידי ריקומבינציה לחיידקים נמענים אחרים.
יישום חוסן נרכש. שינויים בגנום של חיידקים מביאים לכך שחלק מהמאפיינים של תא החיידק משתנים גם הם, וכתוצאה מכך הוא הופך עמיד לתרופות אנטיבקטריאליות. בדרך כלל, ההשפעה האנטי-מיקרוביאלית של התרופה מתבצעת בדרך זו: הסוכן חייב להיקשר לחיידק ולעבור דרך הממברנה שלו, לאחר מכן יש להעביר אותו לאתר הפעולה, ולאחר מכן התרופה מקיימת אינטראקציה עם מטרות תוך-תאיות. יישום של עמידות לתרופות נרכשת אפשרי בכל אחד מהם הצעדים הבאים:
שינוי יעד.ניתן לשנות את אנזים המטרה עד כדי כך שתפקודיו אינם מופרעים, אך היכולת להיקשר לתרופה הכימותרפית (זיקה) מופחתת בחדות או שניתן להפעיל "מעקף" של חילוף החומרים, כלומר אנזים אחר מופעל בתא אשר אינו מושפע מהתרופה הזו.
"חוסר נגישות" של המטרהעל ידי הפחתה חֲדִירוּתדופן התא וממברנות התא או מנגנון "אפלוקו",כאשר התא, כביכול, "דוחף" את האנטיביוטיקה מעצמו.
השבתת תרופות על ידי אנזימים חיידקיים.חלק מהחיידקים מסוגלים לייצר אנזימים ספציפיים שהופכים את התרופות ללא פעילות (למשל, בטא-לקטמאסות, אנזימים המשתנים aminoglycoside, chloramphenicol acetyltransferase). בטא-לקטמאז הם אנזימים המפרקים את טבעת הבטא-לקטם ליצירת תרכובות לא פעילות. הגנים המקודדים לאנזימים הללו מופצים באופן נרחב בין חיידקים ויכולים להיות בכרומוזום או בפלסמיד.
כדי להילחם בהשפעה המנטרלת של בטא-לקטמאסות, משתמשים בחומרים - מעכבים (לדוגמה, חומצה קלבולנית, סולבקטם, טזובקטם). חומרים אלו מכילים בהרכבם טבעת בטא-לקטם ומסוגלים להיקשר לבטא-לקטמים, ולמנוע את השפעתם ההרסנית על בטא-לקטמים. יחד עם זאת, הפעילות האנטיבקטריאלית הפנימית של מעכבים כאלה נמוכה. חומצה קלבולנית מעכבת את רוב הבטא-לקטמאסים הידועים. הוא משולב עם פניצילינים: אמוקסיצילין, טיקרצילין, פיפרצילין.
כמעט בלתי אפשרי למנוע התפתחות של עמידות לאנטיביוטיקה בחיידקים, אבל יש צורך להשתמש אנטי מיקרוביאליםבצורה כזו שלא תתרום להתפתחות והתפשטות העמידות (במיוחד, השתמש באנטיביוטיקה אך ורק על פי האינדיקציות, הימנע משימוש בהן למטרות מניעתיות, שנה את התרופה לאחר 10-15 ימים של טיפול אנטיביוטי, השתמש בתרופות צר-ספקטרום במידת האפשר, הגבל את השימוש באנטיביוטיקה ברפואה הווטרינרית ואל תשתמש בהם כגורם גדילה).
זיהום נוזוקומי - זהו זיהום המתרחש בבתי חולים: שכבה על המחלה הבסיסית, היא מחמירה את המהלך הקליני של המחלה, מסבכת אבחון וטיפול, מחמירה את הפרוגנוזה ותוצאת המחלה, ולעתים קרובות מובילה למותו של החולה.
זיהום נוסוקומיאלי (HAI) הוא אחת מהצורות של iatrogenic, כלומר הקשורים עם התערבויות רפואיות, מחלות. הסוכנים הסיבתיים של VBI יכולים להיות חיידקים פתוגניים, למשל, במקרים של אשפוז של חולה זיהומי במחלקות סומטיות, בידוד לא תקין או לא מושלם של חולים ב מחלקות למחלות זיהומיות, הכנסת פתוגנים לבתי חולים על ידי מבקרים במהלך מגיפות.
סיווג, גישות כלליות לניצוח. שיטות דיפוזיה: שיטת דיסק נייר, E-test.שיטות לקביעת רגישות החיידקים לאנטיביוטיקה מחולקות ל-2 קבוצות:
1. שיטות דיפוזיה:
. באמצעות דיסקים אנטיביוטיים
. באמצעות בדיקות אלקטרוניות
2. שיטות דילול סדרתי:
. רבייה במצע תזונתי נוזלי (מרק)
. דילול במדיום אגר
שיטות לקביעת הרגישות פותחו במחצית השנייה של שנות ה -60 - תחילת שנות ה -70 של המאה העשרים ומאז, מנקודת מבט מתודולוגית, לא עברו שינויים מהותיים.
עבור כל השיטות, השלבים הבאים נפוצים:
- הכנה ובקרת איכות של אמצעי תרבות
- הכנת תרחיף של המיקרואורגניזמים הנחקרים (אינוקולום)
- חיסון
- לשיטות דיפוזיה - שלב הנחת דיסקים או רצועות E-test על מצע מזין צפוף.
- דגירה
- חשבונאות ופרשנות של תוצאות
- גיבוש המלצות טיפול
שיטות דיפוזיה מבוססות על דיפוזיה תרופה אנטיבקטריאלית(ABP) מהנשא לתוך מצע תזונתי מוצק מחוסן במיקרואורגניזם, ומתעד את קוטר אזור העיכוב (השהיה) של צמיחת המיקרואורגניזם הנחקר.
. השיטה פחות רגישה ופחות מדויקת משיטת הדילול הסדרתי, אך נפוץ יותר בפועל בשל פשטותה. מתארח ב- ref.rf.
. קצב הדיפוזיה לאגר של כל תרופה תלוי במבנה שלה, משקל מולקולרי, נוכחות של זיהומים, הרכב ו-pH של המדיום.
שיטת דיסק נייר אנטיביוטי (שיטת דיפוזיה).
. כדי לבצע שיטה זו, משתמשים בדיסקים סטנדרטיים המכילים כמות מסוימת של אנטיביוטיקה, ובמדיום תזונתי סטנדרטי הדרוש לצמיחה של סוג זה של מיקרואורגניזם. בגבולות מסוימים, גודל הקוטר של אזור עיכוב הגדילה עומד ביחס הפוך ל-IPC. . תרחיף חיידקים בצפיפות מסוימת מוחל על פני האגר בצלחת פטרי. . מניחים דיסקים המכילים כמות מסוימת של אנטיביוטיקה. . דגירה בתנאים נוחים לכל מיקרואורגניזם מסוים. . מדדו את הקטרים של אזורי עיכוב הגדילה סביב הדיסק במילימטרים (בהתחשב בקוטר הדיסק). . התוצאה מוערכת על פי טבלה מיוחדת על ידי השוואת קוטר אזורי עיכוב הגדילה של התרבית שנבדקה עם ערכי הגבול של קוטר האזור בטבלה. . היבול הנחקר מסווג לאחת משלוש קטגוריות: רגיש, רגיש בינוני ועמיד. 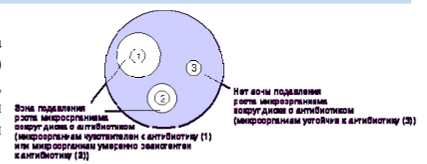
מבחן אלקטרוני (מבחן אלקטרוני או שיטה אפסילומטרית)
השיטה קרובה בטכנולוגיה לשיטת דיסק הנייר.
. משמש כמנשא רצועה צרהפולימר (0.5x6.0 ס"מ), עליו מוחל שיפוע של ריכוזי ABP (ממינימום למקסימום). ערכי ריכוז ה-ABP בכל חלק של הרצועה מסומנים על פני השטח החיצוניים (הפונים אל החוקר).
. עיכוב צמיחת מיקרואורגניזמים סביב רצועת הנשא מתרחשת באזור שבו ריכוז האנטיביוטיקה המתפזרת מהנשא גבוה מה-MIC.
. בהצטלבות אזור עיכוב הגדילה האליפסואידי עם רצועת הבדיקה E, מתקבל ערך ה-MIC.
בדיקת ה-E משלבת את קלות ההגדרה של שיטת דיסק הנייר עם הדיוק של שיטת הדילול הסדרתי. 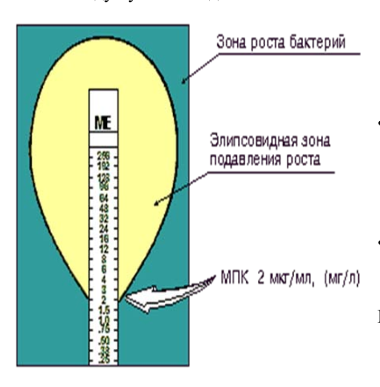
שיטות המשמשות להערכה השוואתית חוץ גופית של תרופות לטיפול אנטי-מיקרוביאלי: שיטת דילול סדרתית במדיות תזונתיות נוזליות ומוצקות.
שיטות דילול סדרתי:
. אפשר לכמת את הרגישות של המיקרואורגניזם המבודד ל חומרים אנטיבקטריאלייםולקבוע את ה-MIC של התרופה.
. משמש להערכה השוואתית של פעילות אנטי-מיקרוביאלית במבחנה של התרופה הגנרית שפותחה ושל התרופה המקורית.
. כדי לקבוע את ערכו של ה-IPC, הריכוזים הנתונים של אנטיביוטיקה מוכנסים למדיום התזונתי, אשר לאחר מכן מחוסן בתרבית של המיקרואורגניזם הנחקר. לאחר הדגירה, נוכחות או היעדר גידול גלוי מוערך.
. מבוסס על שימוש בדילול סדרתי פי שניים של ריכוזי ABP ממקסימום למינימום (לדוגמה, מ-128 מיקרוגרם/מ"ל, 64 מיקרוגרם/מ"ל וכו' ל-0.5 מיקרוגרם/מ"ל, 0.25 מיקרוגרם/מ"ל ו-0.125 מיקרוגרם/מ"ל) .
. מתנהל בחומר תזונתי נוזלי ואגר. שיטת דילול סדרתי במצע תזונתי נוזלי (מרק)
ישנן 2 גרסאות של שיטה זו:
מקרומתוד (שפופרת) ומיקרו-מתוד (טאבלט).
שיטת מאקרו.
. הבדיקה מתבצעת במבחנות בנפח סופי של 1 מ"ל עבור כל דילול.
. המרק התזונתי יוצקים 0.5 מ"ל לכל מבחנה. מספר המבחנות נקבע על פי הטווח הנדרש של דילול ABP.
. הכנת השעיה של המיקרואורגניזמים שנחקרו:
- תרחיף עבודה (~ 10 6 CFU/ml) מוכן מתרחיף סטנדרטי של כל מיקרואורגניזם שנבדק (~ 10 8 CFU/ml). הכנת דילולים סדרתיים כפולים של ABP: - הכן את תמיסת המניות של ABP של התרופה הגנרית שנחקרה ותרופת הייחוס (המקורית) בריכוז של 1000 מיקרוגרם/מ"ל ומעלה (בהתחשב בתוכן של חומר פעיל). - פתרונות עבודה של ABP מוכנים מתמיסות ה-ABP העיקריות של התרופה הגנרית הנבדקת ותרופת הייחוס (המקורית) תוך שימוש בתווך תזונתי נוזלי. (ריכוז תמיסות העבודה מחושב על סמך הריכוז המקסימלי הנדרש בסדרת דילולים סדרתיים, תוך התחשבות בגורם הדילול במהלך החיסון שלאחר מכן עם תרחיף של המיקרואורגניזם) - מכינים דילולים סדרתיים: 0.5 מ"ל של תמיסת העבודה ABP מתווסף למבחנה הראשונה המכילה 0.5 מ"ל של מרק. לְרַגֵשׁ. בעזרת פיפטה חדשה (קצה), העבירו 0.5 מ"ל תמיסת ABP במרק למבחנה שנייה המכילה 0.5 מ"ל מרק וכו', עד להכנת כל סדרת המהולים הדרושה. הסר 0.5 מ"ל מהצינור האחרון. כך מתקבלים מספר צינורות עם תמיסות ABP, שהריכוזים בהן שונים בצינורות סמוכים בפקטור של 2. חיסון: 0.5 מ"ל של תרחיף מיקרוביאלי עם ריכוז מיקרואורגניזם של ~ 10 6 מתווסף לכל צינור עם 0.5 מ"ל מהדילול המתאים של ABP. הריכוז הסופי של המיקרואורגניזם בכל צינור הוא ~ 5x10 5 CFU/ml. . בקרה - מבחנה עם תרבית מרק ומיקרואורגניזמים (בקרת גדילה). בקרה שלילית - שפופרת עם מרק (בקרת סטריליות). . דגירה: כל הצינורות עם הפקקים או המכסים מודגרים בתנאים המתאימים לצמיחה של האורגניזמים שייבדקו. . התחשבנות ופרשנות התוצאות: מבחנות עם גידולים נצפות באור משודר. הצמיחה של התרבית בצינור עם ABP מושווה לצינור הבקרה. - נוכחות של גידול מיקרואורגניזמים במרק (עכירות המרק) מצביעה על כך שהריכוז הנתון של האנטיביוטיקה אינו מספיק כדי לדכא את הכדאיות שלה. - ככל שריכוז האנטיביוטיקה עולה, הצמיחה של המיקרואורגניזם מתדרדרת. הריכוז האנטיביוטי הראשון הנמוך ביותר (מסדרה של דילולים סדרתיים), שבו גידול חיידקים אינו נקבע חזותית, נחשב לריכוז המעכב המינימלי (MIC). תרופות טיפול אנטיביוטי- השוו את התוצאות שהתקבלו עבור התרופה המקורית והתרופה הגנרית שנחקרה. הם מסיקים שהם מקבילים מבחינת הספקטרום (רשימת המיקרואורגניזמים בשימוש) ומידת הפעילות האנטי-מיקרוביאלית (ערכי MIC).  . קביעת MBC: מהמבחנות האחרונות עם עיכוב בגדילה יש לחסן עם לולאה על מגזרי צלחת הפטרי. עבור MBC, אשר, ככלל, הוא מספר דילולים פחות מ-MIC, לקחת את ריכוז התרופה במבחנה האחרונה, חיסון ממנו לא הביא. . חסרון השיטה: פרודוקטיביות נמוכה - היישום מוגבל למחקרים של מספר קטן של מיקרואורגניזמים.
. קביעת MBC: מהמבחנות האחרונות עם עיכוב בגדילה יש לחסן עם לולאה על מגזרי צלחת הפטרי. עבור MBC, אשר, ככלל, הוא מספר דילולים פחות מ-MIC, לקחת את ריכוז התרופה במבחנה האחרונה, חיסון ממנו לא הביא. . חסרון השיטה: פרודוקטיביות נמוכה - היישום מוגבל למחקרים של מספר קטן של מיקרואורגניזמים.
מיקרו-שיטה
.הליך הבדיקה זהה לשיטת המאקרו
.ערך הנפח הסופי הוא עד 0.2 מ"ל. זמינות ציוד מעבדה מתאים: צלחת ל-96 בארות עם פקקים סטריליים, פיפטות רב-ערוציות. רגע השימוש. . יתרונות השיטה: - פרודוקטיביות גבוהה - אפשרות אחסון לטווח ארוך של טבליות מוכנות מראש - חיסכון בחומרים מתכלים. מתארח ב- ref.rf
שיטת דילול סדרתי במדיום אגר. עקרון הבדיקה דומה לשיטת דילול המרק. הכנת תרחיף המיקרואורגניזם הנבדק: - התרחיף הסטנדרטי של כל מיקרואורגניזם נבדק צריך להכיל ~ 10 8 CFU/ml. - סטנדרטי השעיה מיקרוביאליתעבור הניסוי, דלל ~ 10 פעמים כדי לקבל ריכוז מיקרואורגניזם של ~ 10 7 CFU / ml. הכנת דילולים סדרתיים פי שניים של ABP עבור תרופה מקוריתותרופת המחקר הגנרית מתבצעת בדומה לשיטת דילול המרק. את מדיום האגר ממיסים ומצננים לטמפרטורה של 45-50 מעלות צלזיוס. . הכנת כלים עם דילול אגר מדיום ו-ABP: מערבבים את מדיום האגר ותמיסות ABP ישירות בצלחת פטרי (לכלי פלסטיק בקוטר 90 מ"מ מוסיפים 18 מ"ל אגר מומס ומקורר ל-2 מ"ל תמיסת ABP). . חיסון ודגירה: 1-2 μl מהתרחיף של המיקרואורגניזמים שנחקרו מועבר עם לולאה בקטריולוגית אל פני המדיום של האגר. לפיכך, מינון החיסון הסופי הוא ~ 10 4 CFU (לולאה בקטריולוגית סטנדרטית בקוטר של 3 מ"מ נושאת 1-2 μl של נוזל). . על פני האגר נוצר כתם בקוטר 5-8 מ"מ. לאחר הייבוש, הכלים הופכים ומודגרים בתנאים נוחים לצמיחת המיקרואורגניזמים הנחקרים. . חשבונאות ופרשנות תוצאות: בדומה לשיטת דילול המרק. צלחות פטרי מונחות על משטח כהה ולא מחזיר אור. ה-MIC נלקח כריכוז ABP שגרם לעיכוב מוחלט של הצמיחה הנראית לעין. . בקרה: צלחות אגר ללא ABP מחוסנות בתרחיף של תרביות מיקרואורגניזמים (בקרת גדילה). בקרה שלילית: לוחות אגר (בקרת סטריליות). יתרונות השיטה: על גבי כוס אחת ניתן לקבוע את הרגישות של מספר מיקרואורגניזמים.
היקף המחקרים על הערכה השוואתית של פעילות אנטי-מיקרוביאלית במבחנה עבור חומרים אנטי-מיקרוביאליים גנריים ומקוריים.
היקף המחקר על הערכה השוואתית של פעילות אנטי-מיקרוביאלית חוץ גופית של תרופות אנטי-מיקרוביאליות גנריות:
.משימת המחקר: אישור התאימות של התרופה הגנרית להתייחסות (המקורית) מבחינת הספקטרום (מיקרואורגניזמים) ומידת (ערך MIC, MBC) של פעילות אנטי-מיקרוביאלית.
סט של מיקרואורגניזמים שנבדקו: 1-2 זנים של כל אחד מהמיקרואורגניזמים הכלולים בספקטרום הפעולה
- זני איסוף ייחוס
- זנים קליניים מבודדים בבתי חולים
.הערכים של IPC ו-MBC נקבעים
שליטה: תרופת ייחוס - תרופה מקורית
התוצאה הצפויה: MIC ו-MBC של התרופות האנטי-מיקרוביאליות הגנריות שפותחו נמצאים בטווחי הערכים המקובלים ועומדים בקנה אחד עם ה-MIC וה-MBC של תרופות הייחוס (תרופות מקוריות) ביחס לאיסוף וזנים קליניים.
סדר המחקרים לקביעת הפעילות האנטי-מיקרוביאלית במבחנה של תרכובות אנטי-מיקרוביאליות חדשות:
הערכה ראשונית של רגישות לתרכובות חדשות של זני ייחוס סוגים שוניםמיקרואורגניזמים גרם שליליים וגרם חיוביים (4-5 זנים לכל מין);
מחקר מפורט של מידת הפעילות האנטיבקטריאלית של תרכובות נגד זנים של מיקרואורגניזמים גרם שליליים וגרם חיוביים מאוספים בינלאומיים עם מנגנונים ידועיםהתנגדות (שיטת דילול סדרתי);
.מחקר פעילות נגד זנים קליניים של אופורטוניסטים ו מיקרואורגניזמים פתוגנייםלְעוּמַת סמים מוכריםקבוצה כימית קרובה או דומה בהשפעה אנטי-מיקרוביאלית:
- במקרה של פעילות דומיננטית נגד מיקרואורגניזמים חיוביים לגרם, בקרה - פניצילינים טבעיים, צפלוספורינים מהדורות I-II, מקרולידים, לינקוסאמידים; - עם פעילות נגד מיקרואורגניזמים גרם שליליים, שליטה - polymyxin B, aztreonam; - לסמים טווח רחבבקרת פעולה - פניצילינים חצי סינתטיים, אמינוגליקוזידים, טטרציקלינים, צפלוספורינים דורות III - IV
. הערכת פעילות אנטי-מיקרוביאלית כנגד פתוגנים בעייתיים: סטפילוקוקוס עמידים למתיצילין, דלקת ריאות מסוג Streptococcus עמידים לבנזילפניצילין, אנטרובקטריות עמידות רב, חיידקים עמידים לאמינוגליקוזידים מהסוג Pseudomonas וכו'.
הריכוזים הטיפוליים הראשוניים של תרופות חדשות נקבעים תוך התחשבות ברעילות שנקבעה בניסויים בחקר רעילות חריפה;
. מידת הפעילות האנטיבקטריאלית ההשוואתית של תרופות מוערכת לפי הערך של ה-IPC או MBC, שנקבע על ידי לפחות 2 ערכים של מנת הזרע: המינימום - 10 4 - 10 5 CFU / מ"ל והמקסימום - 10 6 - 10 9 CFU/ml, תלוי בסוג הפתוגן; נכון להיום, אין שיטות שיאפשרו בוודאות מוחלטת לחזות השפעה קליניתאנטיביוטיקה בטיפול במחלות זיהומיות. עם זאת, נתוני רגישות יכולים לשמש קו מנחה טוב לרופאים לבחור ולהתאים טיפול אנטיביוטי.
שם הספר פתוח סגור
1. מיקרוביולוגיה פרמצבטית. נושא ומשימות של מיקרוביולוגיה פרמצבטית.
2. רוקחות ותרופות: היסטוריה של מוצא והתפתחות.
3. סם: הגדרה, סיווג.
4. הרכב התרופות | חומר פרמצבטי, חומר עזר.
5. תרופות מקוריות וגנריות. שם התרופות.
10. השפעת גורמים מזיקים על מיקרואורגניזמים. השפעת גורם הטמפרטורה והשימוש בו בתרופות.
11. השפעת הקרינה על מיקרואורגניזמים, סוגי קרינה.
12. השפעת גורמים מזיקים כימיים על מיקרואורגניזמים
13. עיקור. רמת אבטחת סטריליות (SAL). קריטריונים לבחירת שיטת עיקור.
14. עיקור תרמי וכימי
15. ניטור יעילות מכשירי העיקור.
16. חיטוי תעשייתי
17. חומרי חיטוי וחומרי חיטוי. דרישות לחומרי חיטוי וחומרי חיטוי כימיים.
