Único a su manera proporciona su diversidad y características de la vida.
La microbiología moderna para el estudio y la clasificación utiliza los siguientes características distintivas bacterias:
- Estructura celular morfológica:
- "cocos" esféricos;
- "bacilos" en forma de bastón;
- "espiroquetas" espirales;
- forma intrincada "vibriones".
- Aliento:
- respirar oxígeno "aeróbico";
- anóxico "anaeróbico".
- Método de alimentación:
- autotrófico "independiente" - capaz de sintetizar materia orgánica de lo inorgánico con la ayuda de la energía reacciones químicas o fotosíntesis (por ejemplo, algas verdeazuladas);
- heterótrofo: convierta y procese sustancias orgánicas preparadas obtenidas como resultado de la actividad vital de otros organismos, esto incluye microorganismos patógenos (patógenos) y simbióticos (beneficiosos), así como bacterias que viven debido a los procesos de fermentación, descomposición, etc. .
- Hábitat:
- ambiente externo (suelo, agua, etc.);
- dentro de los organismos vivos;
- materia orgánica muerta (cadáveres, sedimentos, productos de desecho).
- Método de distribución y supervivencia (ya sea que se formen esporas celulares, vainas, moco).
- Reacción a la prueba de Gram (separación según la composición y estructura de los muros, clasificación clave en el contexto del tema de la estructura pared celular):
- grampositivo: teñido durante el procedimiento de tinción de Gram (la cubierta es permeable al tinte de anilina (violeta cristal, violeta de metilo, etc.));
- Gram-negativo: no se tiñe durante el procedimiento de tinción de Gram (la pared celular es impermeable al tinte).
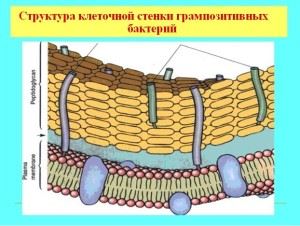
Características de la pared celular de las bacterias grampositivas
La esencia de la prueba (propuesta por G.K. Gram en 1884) es el procedimiento para procesar una muestra de un cultivo bacteriano con un tinte de anilina (cristal violeta, cristal violeta). Tras el lavado posterior con alcohol, las especies de microorganismos Gram (+) conservan su color azul, mientras que otras se decoloran. La capacidad de la pared celular para fijar el tinte está determinada por la composición y estructura de la pared celular. La clasificación de los organismos unicelulares según el tipo de estructura de la pared celular que se puede teñir o no mediante el método de Gram es una de las claves. En la práctica, los resultados de la prueba de Gram ayudan a diagnosticar enfermedades infecciosas estudiar propiedades bioquimicas microorganismos
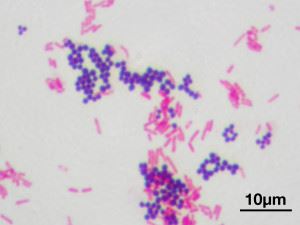
Tinción de Gram. Cocos (esféricos) - grampositivos y bacilos (bastones) - gramnegativos
La mayoría de las bacterias grampositivas tienen una membrana masiva de una sola capa que es permeable al tinte de anilina. La composición de la pared incluye moléculas orgánicas complejas, la base de la rigidez mecánica está dada por murein (heteropolímero), glicopéptidos, mucopéptidos. La estructura de la pared determina la forma del microorganismo y es algo así como un esqueleto externo, con una estructura porosa, de unas 40 moléculas de glicopéptido de espesor. Además de la base de peptidoglicano, la cubierta contiene ácidos teicoicos y polisacáridos.
A pesar de reacción general en el tinte, entre los organismos grampositivos se pueden encontrar organismos que pertenecen a una variedad de subespecies, diferentes formas, tamaño, hábitat y modo de alimentación.
La mayoría de las bacterias patógenas para los humanos son gra-positivas, entre las cuales, por ejemplo, los agentes causantes de tales enfermedades infecciosas:
- tétanos (Clostridium tetani),
- botulismo (Clostridium botulinum),
- ántrax (),
- estreptococos,
- estafilococos (Staphylococcus aureus), que son altamente resistentes a la temperatura y la acción medicamentos.
Resistentes a los ácidos, debido a la estructura multicapa especial de la cubierta (que incluye ceras, polisacáridos y proteínas), por regla general, no se tiñen con el método de Gram. Para ellos, se utiliza un método especial de Ziel-Nelsen. pero algunos dan resultado positivo según el método de Gram en el caso de una concentración muy alta del colorante o temperatura elevada durante el procedimiento.
Los organismos unicelulares resistentes a los ácidos sobreviven en medios ácidos y ambientes alcalinos, aunque el medio normal para su desarrollo y crecimiento es neutro. generalmente clasificado como Gram-positivo. Los representantes de este grupo peligroso para las personas y los animales son los agentes causantes de enfermedades como la tuberculosis y la lepra. También son resistentes a los ácidos algunas bacterias del suelo capaces de fijar el nitrógeno atmosférico y ser simbiontes de las plantas.
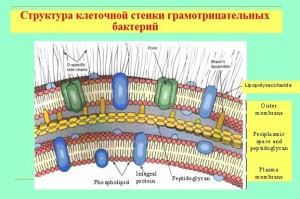
Características de la cubierta de bacterias gramnegativas.
Aunque el grosor de la pared de su mucopéptido es mucho más delgado, la pared es impermeable al tinte cristal violeta. Se trata de una estructura y composición química fundamentalmente diferentes de la célula. La calota tiene una estructura multicapa y consta de:
- la capa externa (membans), su principal composición son liposacáridos y proteínas;
- espacio periplásmico;
- la capa interna (murein peptidoglicano), su composición es similar a la de las paredes de las bacterias grampositivas, pero, por regla general, más de dos veces más delgada.
gracias a mas Estructura compleja algunos miembros de este grupo tienen mayor resistencia a anticuerpos y antibióticos.
Con la complicación de la pared celular han aparecido nuevas funciones y posibilidades. Algunos tipos de bacterias que viven en superficies duras, adquirió la capacidad de cambiar la forma de la celda (las paredes del "esqueleto" se convirtieron en plástico). Esto es importante al deslizarse y moverse sobre los desniveles de un hábitat sólido.
El espacio periplásmico adquirió la función de lugar aislado de almacenamiento de algunas enzimas hidrolizantes necesarias para la vida de la célula, pero al mismo tiempo capaz de descomponer las moléculas poliméricas de la propia bacteria. Debido a la hidrólisis de las moléculas de polímero que ingresan desde el exterior celula viva amplía la gama de sustancias aptas para la nutrición, al mismo tiempo, la membrana interna, impermeable a las enzimas, impide la “autodigestión” de la célula bacteriana.
La estructura de la membrana externa incluye proteínas que pueden formar poros hidrófilos a través de los cuales algunas macromoléculas (azúcares y aminoácidos) necesarias para la nutrición bacteriana pueden pasar al interior de la célula.
Esta clase de bacterias incluye muchas bacterias que pueden cambiar composición química hábitat (bacterias de fermentación acética y alcohólica); simbiótico: Escherichia coli (E coli), muchos organismos patógenos (causantes de enfermedades), como el meningococo (Neisseria meningitidis); legionella (Legionella pneumophila), y el famoso Helicobacter pylori desafiante úlcera péptica y alta resistencia a los ácidos.

Uso humano de las características estructurales de las bacterias.
Los primeros microorganismos que fueron utilizados por el hombre para sus necesidades fueron las bacterias de la fermentación láctica y alcohólica. Fueron ellos quienes cocinaron para nosotros y aún cocinan queso, pan y vino. Además, las personas comenzaron a utilizar el producto de su trabajo mucho antes del descubrimiento de las bacterias y del comienzo del estudio de la estructura y composición de sus productos metabólicos.
En la actualidad, los métodos biológicos para el tratamiento de aguas residuales y fecales están disponibles no sólo empresas municipales sino también a los propietarios de viviendas particulares. Las culturas latentes son parte de drogas modernas para pozos negros y alcantarillas locales. Granjas a menudo se usa resistente a los ácidos para el procesamiento de alta velocidad de compost y desechos animales en fertilizantes y para muchos otros propósitos.
Además, muchas bacterias genéticamente modificadas están involucradas en la producción de medicamentos, la síntesis de nuevos tipos de polímeros y otros materiales con propiedades únicas. propiedades químicas y estructura compleja.
Los componentes químicos de la pared celular suelen dividirse en básicos, incrustantes y depositados en su superficie (adcrustantes). a la principal componentes químicos incluyen celulosa, hemicelulosa, pectina, proteínas. Los componentes que incrustan la pared celular son la lignina y la suberina. La cutina y la cera se pueden depositar en la superficie de la pared celular. Además, las paredes celulares contienen silicatos y carbonatos de calcio.
Los componentes más comunes de los materiales vegetales renovables son la celulosa, la lignina y las hemicelulosas (poliosas), que suman 40, respectivamente; 30 y 26% de ella peso total. La celulosa es un material de refuerzo de las paredes celulares, formando estructuras filamentosas ordenadas (fibrillas). La lignina y las hemicelulosas son biopolímeros amorfos con una estructura reticular o ramificada y desempeñan el papel de aglutinantes (rellenos).
La estructura de estas sustancias, su interacción intermolecular determinan las propiedades de los sustratos vegetales en su conjunto y su comportamiento durante el procesamiento.
Celulosa
La celulosa es la sustancia más común en la Tierra, es el esqueleto de la pared celular de las plantas. La estructura de la celulosa de la fibra de algodón y fibras sintetizadas por algunas bacterias, algas y moluscos se estudia mejor, ya que la celulosa se encuentra en su forma más pura. En la madera, se presenta únicamente en forma de un compuesto con otros biopolímeros, de donde es difícil extraerlo sin destrucción parcial.
Químicamente, la celulosa es un polisacárido, cuyas macromoléculas se construyen a partir de residuos de ß-D-glucosa y representan una cadena lineal de unidades de anhidroglucopiranosa conectadas por enlaces 1,4-glucosídicos (Fig. 9).
Figura 9. Estructura química celulosa
Es un polímero estereorregular, en cuya cadena un residuo de celobiosa sirve como enlace estereorrepetitivo. La fórmula total de la celulosa tiene la forma - (C 6 H 10 O 5) n o [C 6 H 7 O 2 (OH) 3] n. La unidad monomérica de celulosa contiene tres grupos hidroxilo de alcohol, de los cuales uno es primario: CH 2 OH, y dos en C 2 y C 3 son secundarios: CHOH. Los eslabones finales son diferentes del resto de los eslabones de la cadena. Un enlace terminal (en C4) tiene un hidroxilo de alcohol secundario libre adicional. El enlace terminal (en C 1) contiene un hidroxilo glucosídico libre (semiacetal) y puede existir en dos formas tautoméricas: cíclica (semiacetal) y abierta (aldehído). El grupo aldehído terminal le da a la celulosa una capacidad reductora (restaurante). La capacidad de la celulosa para sufrir una reacción de reducción se puede utilizar para caracterizar la longitud de sus cadenas, que es característica de esta especie plantas.
En el residuo de glucosa, se acostumbra distinguir planos hidrofílicos e hidrofóbicos, dependiendo de cuántos grupos OH y CH le correspondan. Esto es importante cuando se estudia la interacción de un residuo de glucosa con residuos de aminoácidos aromáticos durante la escisión enzimática de una molécula de celulosa en el centro activo de la enzima.
Debido al hecho de que los grupos hidroxilo en el primer y cuarto átomos de glucosa difieren en su ubicación con respecto al plano del anillo, los residuos de glucosa vecinos en la cadena polimérica resultan estar rotados 180 0 entre sí. Las cadenas de polímeros se estabilizan mediante enlaces de hidrógeno formados entre los residuos de glucosa durante la interacción de los grupos hidroxilo en los átomos de carbono 6,2,3 y el oxígeno del anillo. Las cadenas poliméricas lineales están interconectadas mediante enlaces de hidrógeno intermoleculares que surgen entre los átomos de oxígeno de una cadena y los grupos hidroxilo en el C 6 de la glucosa de otra cadena (Fig. 10). Como resultado de tales interacciones, se forman fibras fuertes. La flexibilidad de la molécula de celulosa está determinada por la posibilidad de rotación de los residuos de anhidroglucosa en el enlace de celobiosa con respecto al enlace glucosídico. La estabilidad de la conformación lineal de la celulosa está determinada, en particular, por la mínima repulsión de C1-H y C4-H.
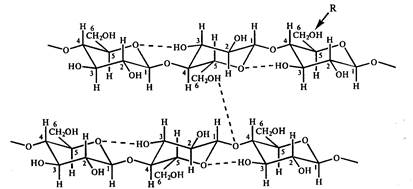
Arroz. 10. Representación esquemática del sistema de puentes de hidrógeno entre residuos de glucosa en celulosa. R es el centro de posible modificación química de la celulosa. Entonces, en metilcelulosa, acetilcelulosa y carboximetilcelulosa R \u003d CH 3, COCH 3, CH 2 COOHa, respectivamente
La molécula de glucosa se presenta en conformación de silla, en la que los átomos C2, C3, C5 y O5 se encuentran en el mismo plano, y los átomos C1 y C4 se encuentran en lados opuestos. El residuo de glucosa también puede tomar conformaciones energéticamente menos favorables, las cuales, según el grado de estabilidad, se ordenan en el siguiente orden: conformación oblicua, conformación de bote (o baño), y la conformación de media silla menos favorable, en la que 5 átomos del anillo de piranosa de 6 miembros caen en un plano a la vez. La capacidad de la unidad de anhidroglucosa para aceptar en la molécula de celulosa, además de las conformaciones más estables, menos estables (por ejemplo, la conformación de un bote o una conformación de media silla) ha importancia en violación de la estructura supramolecular ordenada de la celulosa, así como en la hidrólisis enzimática de los enlaces glucosídicos en su molécula.
Las fibras elementales (micelas) de celulosa consisten en 100-200 cadenas poliméricas conectadas por puentes de hidrógeno. Estas fibras en la pared celular son paralelas entre sí y se agrupan de tal manera que se forman haces de forma ovalada. – microfibrillas . Aproximadamente 10 micelas forman una microfibrilla con un diámetro de 0,025 nm (Fig. 11).
Cada paquete tiene una parte cristalina central: el núcleo, en el que las cadenas están tan apretadas que incluso las moléculas de agua las penetran con gran dificultad. Alrededor del núcleo hay una corteza paracristalina con una estructura menos ordenada. Estas regiones menos ordenadas, también denominadas regiones amorfas, suelen comprender alrededor del 15% de la microestructura de la celulosa. Las microfibrillas pueden coalescer en grupos individuales o capas – macrofibrillas - 0.4-0.5 micrones de espesor, visibles en un microscopio óptico. El diámetro y el grado de cristalinidad de las microfibrillas varían mucho según el tipo de planta y el estado fisiológico de la célula.
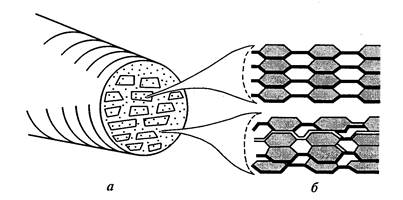
Figura 11. Modelo de estructura de microfibrillas: a) sección transversal de microfibrillas con micelas y espacios intermicelares; b) diseño de celulosa
Para pulpa de madera con un índice de ordenamiento de 50-70%, las dimensiones transversales del cristalito no exceden los 4x6 nm. Según la microscopía electrónica, las dimensiones promedio en diámetro pueden ser de 1,5-2x2,5-3,5 nm. Del 40 al 80% de las moléculas con tales tamaños se encuentran en la superficie del cristalito, donde es posible su mayor hidratación, la violación del orden de largo alcance en la estructura de los enlaces de hidrógeno y también una mayor influencia de las influencias químicas.
La celulosa natural es polidispersa, el número de residuos de glucosa en una molécula de celulosa y, en consecuencia, la longitud de las moléculas en sí pueden variar drásticamente en paredes celulares varias plantas Entonces, para la celulosa del cabello de algodón, el grado de polimerización de la pared celular primaria es de 2-6 mil, la secundaria - 13-14 mil, para la celulosa Acetobacter xylinum - 2-6 mil, para la madera - 8-10 mil. El peso molecular máximo experimentalmente establecido de celulosa de lino es 6 000 000. Debido al hecho de que el grado de polimerización es un indicador promedio, la característica más precisa es la curva de distribución de las moléculas de celulosa a lo largo de la longitud (distribución del peso molecular). Sin embargo, esta característica es difícil de obtener y, por lo tanto, se utilizan características promedio: grados de polimerización promedio en número (DP n) y promedio en peso (DP w). El grado de polimerización promedio en número es igual al número total de residuos de anhidroglucosa en la muestra de celulosa dividido por numero total moléculas de polímero. Para determinarlo, se titulan los extremos reductores en la muestra de polisacáridos. El grado medio ponderal de polimerización de la celulosa se determina disolviendo una muestra de celulosa en un complejo alcalino de cobre, zinc, cobalto o cadmio con etilendiamina, o en un complejo de LiCl con N,N'-dimetilacetamida. relación DP w/DP norte es igual a la unidad solo para polímeros monodispersos.
Para la pulpa de madera de abeto, pino, abedul y álamo temblón, el grado de polimerización promedio en peso es 12000, mientras que la longitud de tal molécula en el estado extendido alcanza casi 6 micras, que es 6000 veces mayor que su diámetro. Una molécula tan larga y de construcción regular se apila de cierta manera. El método de apilamiento determina la estructura supramolecular del biopolímero, que se basa en enlaces de hidrógeno intramoleculares e intermoleculares formados por unidades de celobiosa. El estudio del método de apilamiento y tipos de puentes de hidrógeno en la macromolécula de celulosa se realiza mediante análisis conformacional, difracción (dispersión de rayos X de ángulo pequeño, dispersión de electrones), espectroscopia IR y RMN. A pesar de los importantes avances en este campo, la cuestión de cómo apilar las moléculas de celulosa no se ha resuelto finalmente.
La celulosa es insoluble en agua y disolventes orgánicos, químicamente inerte, mecánicamente muy fuerte. El agua entre superficies de cristalitos estrechamente espaciadas, pero que no interactúan directamente, está estructurada. La eliminación del agua de hidratación, por ejemplo, como resultado del secado, promueve la convergencia de moléculas de celulosa inicialmente sin contacto y la formación de varios tipos de enlaces de hidrógeno entre ellos, que no se destruyen durante la rehidratación. Los investigadores atribuyen el aumento en el grado de cristalinidad durante la humectación a la penetración del agua desde las regiones menos ordenadas a las más ordenadas. Como resultado, se observa una disminución en los tamaños absolutos de los cristalitos y un aumento en el grado de ordenamiento general. Se cree que el agua en este caso actúa de acuerdo con el principio de "lubricación molecular", lo que facilita que los fragmentos desordenados de moléculas completen la estructura ordenada a través de la interacción cooperativa con una "semilla" cristalina. La sustitución de los grupos polares de la celulosa, por ejemplo, con carboximetilo, conduce a una violación de la regularidad molecular, promueve la formación de muchos enlaces de hidrógeno con el agua y hace que la celulosa sea soluble.
La resistencia de la celulosa al desdoblamiento, tanto en condiciones naturales como de laboratorio, se debe no tanto a las características del enlace b-1,4-glucosídico, sino a la estructura cristalina de la celulosa y al especial “empaquetamiento” de sus moléculas en estructuras biológicas.
Las enzimas celulolíticas no pueden penetrar en las estructuras internas de las fibrillas de celulosa. Actúan sobre su superficie. El número de enlaces glucosídicos disponibles para la acción de las enzimas depende en gran medida del grado de hinchamiento de la celulosa. Se puede lograr un aumento en el grado de hinchamiento mediante un pretratamiento: vaporización, molienda, sonicación, etc. El hinchamiento de toda la fibra aumenta con los ácidos minerales y los álcalis en altas concentraciones, ya que son capaces de romper puentes de hidrógeno y penetrar en regiones cristalinas. Las secciones amorfas de la celulosa se ven afectadas con relativa facilidad por ácidos y álcalis.
Bajo la acción de soluciones alcalinas concentradas sobre la celulosa, sus propiedades fisicoquímicas y estructurales cambian: se nota un hinchamiento intenso y cambia el grado de cristalinidad. La fracción de alto peso molecular de la celulosa, insoluble en NaOH al 17,5%, se denomina a-celulosa. El algodón se compone predominantemente de a-celulosa, mientras que otras plantas y la madera contienen predominantemente b-celulosa, soluble en una solución alcalina concentrada.
Las microfibrillas están inmersas en una matriz de cubierta amorfa, que es una mezcla compleja de polímeros, entre los que predominan los polisacáridos de varios pesos moleculares. Se supone que en la superficie de todas las microfibrillas hay una capa de moléculas de xiloglucano absorbidas por enlaces de hidrógeno. La lignina y las hemicelulosas llenan el espacio entre las fibrillas elementales de celulosa. Así, la sustancia lignificada es una estructura polimérica constituida por un refuerzo de celulosa inmerso en una matriz lignocelulósica.
La celulosa y las hemicelulosas se caracterizan por diferentes cinéticas de formación, lo que aparentemente indica diferentes lugares su síntesis. La síntesis de celulosa parece ocurrir fuera de la célula en la superficie. membrana citoplasmática con la participación de GDF o UDF. Los donantes de grupos glucosilo son los difosfatos de nucleósidos de azúcar, que se forman a partir de glucosa y sacarosa. diferentes caminos. Por ejemplo, a partir de nucleósidos trifosfatos y azúcar-1-fosfatos con la participación de pirofosforilasa. Los residuos de glucosilo se unen a los residuos de azúcar en los extremos no reductores de la cadena de crecimiento. Entre el primer carbono del residuo “añadido” y el grupo hidroxilo del cuarto átomo de carbono del residuo terminal, surge un enlace glucosídico con la participación de la sintetasa.
N (Nucleósido difosfato azúcar) + (azúcar) n sintetasa n (Nucleósido difosfato) + (azúcar) n +1
En la pared celular se encontraron enzimas de síntesis de celulosa y gránulos de 8 nm de diámetro, que al parecer son complejos multienzimáticos ubicados en Superficie exterior plasmalema y en la matriz de la pared. La celulosa sintetasa (E) en el plasmalema está asociada con la proteína P activadora, que puede unirse a GTP y pasar a la forma activa con la formación del complejo P-E-GTP.
En el proceso de síntesis de celulosa, no solo se forman cadenas de celulosa individuales, sino también microfibrillas de celulosa. Tal síntesis probablemente se lleva a cabo con la participación de muchas moléculas de celulosa sintetasa concentradas en lugares separados del plasmalema, y las celulosa sintetasa consisten en muchas subunidades, cada una de las cuales es responsable de la síntesis de una sola cadena de glucano. En adentro membranas, se encontraron “rosetas” de seis glóbulos de proteína. Las rosetas se secretan en el plasmalema a través de un sistema de endomembranas de vesículas. Sobre la base de las características de la conexión estructural de rosetas, complejos terminales y las microfibrillas de celulosa resultantes, surgió una suposición sobre el mecanismo de formación de microfibrillas en una estructura transmembrana complementaria: rosetas - complejo terminal - extremo creciente de la microfibrilla. Un complejo terminal está conectado al final de la microfibrilla recién sintetizada, y las rosetas son el sitio de unión de los precursores de celulosa y la excreción de "portadores" de residuos de glucosa.
Las rosetas individuales, junto con los complejos terminales correspondientes, son responsables de la síntesis de microfibrillas de la pared celular primaria orientadas aleatoriamente (Fig. 12), y un conjunto orientado de hasta 175 rosetas en secciones separadas del plasmalema determina la formación de rosetas paralelas. microfibrillas de la pared celular secundaria (Fig. 13).
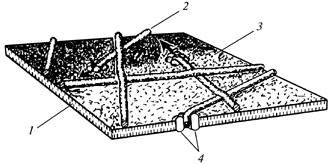
Fig. 12. Microfibrillas de celulosa durante la formación.
pared celular primaria: 1
- doble capa lipídica; 2
- microfibrilla; 3
- superficie exterior del plasmalema; 4
- enchufe
Cada roseta forma una microfibrilla con un diámetro de 5 nm. La distancia entre filas de rosetas en la membrana plasmática corresponde a la distancia entre microfibrillas en la pared celular. Las microfibrillas delgadas contienen alrededor de 50 cadenas de poliglucano. Estas microfibrillas forman fibrillas de la pared celular secundaria, que pueden tener hasta 28 nm de diámetro. La celulosa, a diferencia del almidón, es un compuesto difícil de metabolizar. Su digestibilidad está determinada por el origen, el contenido en la dieta, la naturaleza del pretratamiento y oscila entre un 6 y un 23% de media. Sí, digestibilidad de la celulosa salvado de trigo aproximadamente 15%.
![]()
Arroz. 13. Microfibrillas de celulosa durante la formación.
pared celular secundaria: 1
- enchufe; 2
- doble capa lipídica
EN fibra dietética la celulosa constituye aproximadamente un tercio. Su descomposición efectiva ocurre como resultado de la interacción simbiótica de varios microorganismos del intestino grueso y sus enzimas celulolíticas. EN tubo digestivo la celulosa estimula la actividad del intestino, aumentando su peristalsis, normaliza la actividad microflora intestinal, absorbe los esteroles, impide su absorción y favorece la liberación de colesterol. La celulosa microcristalina (MCC), una modificación en polvo no fibrosa de la celulosa natural, ha encontrado una amplia aplicación como complemento alimenticio. No solo reduce el contenido calórico de los alimentos, sino que también es su espesante y dispersante, lo que mejora la calidad de los alimentos.
Las eubacterias gramnegativas tienen una estructura de pared celular mucho más compleja que las grampositivas. Contiene un número mucho mayor de macromoléculas de diferentes tipo químico. El peptidoglicano forma solo la capa interna de la pared celular, ligeramente adyacente al CPM. Para diferentes tipos Eubacterias gramnegativas, el contenido de este heteropolímero varía ampliamente. En la mayoría de las especies, forma una estructura de una o dos capas, caracterizada por enlaces cruzados muy raros entre las cadenas de heteropolímeros.
Algunas bacterias deslizantes (mixobacterias, flexibacterias) pueden cambiar periódicamente la forma de las células en el proceso de moverse a lo largo de un sustrato sólido, por ejemplo, al doblarse, lo que indica la elasticidad de su pared celular y principalmente su capa de peptidoglicano. Sin embargo, el examen con microscopio electrónico reveló que tenían una pared celular típica de las eubacterias Gram-negativas. La explicación más probable de la flexibilidad de la pared celular de estas bacterias es el entrecruzamiento extremadamente bajo de su componente de peptidoglicano.
Los procariotas gramnegativos tienen membrana externa, que incluye lípidos (22%), proteínas, polisacáridos, lipoproteínas.
Los lipopolisacáridos (LPS) son heteropolímeros con una estructura compleja que tienen una variedad de actividades biológicas. El complejo lipoide causa toxicidad (reacciones inflamatorias, fiebre, choque de endotoxinas), el componente polisacárido es responsable de la especificidad del antígeno O. El LPS induce la síntesis de anticuerpos Jg M y se utiliza en inmunología como adyuvante y activador policlonal de células B.
La pared celular de las bacterias realiza principalmente funciones protectoras y moldeadoras, proporciona rigidez, forma una cápsula y determina la capacidad de las células para adsorber fagos.
№15 Formas involutivas filtrables de bacterias, protoplastos, esferoplastos, formas L.
protoplastos, esferoplastos, formas de L son formas de bacterias sin Kansas
Las formas L pueden ocurrir en condiciones naturales en el organismo de una persona como resultado del tratamiento a largo plazo con ciertos antibióticos, con mayor frecuencia penicilina.
Hay formas L inestables y estables de bacterias. Los primeros son susceptibles de revertirse a su forma original cuando se elimina la causa que motivó su formación. Restauran la capacidad de sintetizar peptidoglicano CS. Estos últimos, por regla general, no son susceptibles de reversión. Las formas L de varias bacterias juegan un papel esencial en la patogénesis de muchas enfermedades infecciosas.
Las principales propiedades de las formas L de bacterias:
una constante transformación de grampol-s a grammatrits-e.
cambio en las propiedades antigénicas
disminución de la virulencia
capacidad de persistencia a largo plazo
capacidad de volver a su forma original en caso de pérdida incompleta de la sinetza del COP.
№16 Propiedades tintóreas de las bacterias. Métodos de tinción sofisticados. Principio de la tinción de Gram de bacterias.
Técnica de tinción de Gram
Se coloca papel de filtro sobre el frotis y se vierte una solución carbólica de violeta de genciana durante 1-2 minutos.
Retire el papel, escurra el colorante y, sin lavar el frotis con agua, vierta la solución de Lugol durante 1 minuto.
Se drena la solución de Lugol y se decolora la preparación en alcohol 96 0 durante 30 seg.
Lavado con agua.
Pintar 1-2 minutos solución acuosa magenta.
El principio del cerco por gramo
Gram positivas las bacterias retienen violeta de genciana en combinación con yodo - colorante morado bacterias;
Gram negativo las bacterias después de la exposición al alcohol pierden el tinte, se decoloran y, cuando se tratan con fucsina, se tiñen en color rojo.
Métodos complejos Las tinciones se utilizan para estudiar la estructura celular y la diferenciación de microorganismos. Los frotis teñidos se microscopian en un sistema de inmersión. Aplicar consistentemente a la preparación ciertos tintes que difieren en composición química y color, mordientes, alcoholes, ácidos, etc.
propiedades tintóreas bacterias (lat. tinctura, de tingo - yo color) la capacidad de colorear: susceptibilidad al color, resistencia ácido-alcohol-álcali, uniformidad del color, metacromaticidad, relación con el color por el método de Gram.
№17 Características de la composición química de la pared celular de bacterias resistentes a los ácidos. El principio de tinción según el método de Ziehl-Neelsen.
bacterias resistentes a los ácidos. La pared celular de algunas bacterias contiene una gran cantidad de lípidos y ceras, lo que las hace resistentes a la decoloración posterior después de la tinción con ácidos, álcalis o etanol (por ejemplo, especies de Mycobacterium o Nocardia). Estas bacterias se denominan acidorresistentes y difíciles de teñir con Gram (aunque las bacterias acidorresistentes se consideran grampositivas). Para su coloración se utiliza el método de Ziehl-Neelsen.
Las micobacterias y la nocardia se caracterizan por una estructura complicada de la pared celular. Ellos, al igual que las bacterias Gram-positivas, se basan en un marco de mureína, pero este último se asocia con polisacáridos y lípidos. Los lípidos están representados por ácidos micólicos, que dan hidrofobicidad a la superficie celular. La hidrofobicidad, por un lado, hace que la célula sea resistente a la acción de diversos productos químicos (tales bacterias se denominan resistentes a los ácidos), por otro lado, inhibe el intercambio de la célula con el medio ambiente y ralentiza su crecimiento. Por lo tanto, los tensioactivos se añaden a los medios nutrientes para el cultivo de Mycobacterium tuberculosis. La resistencia a los ácidos de las micobacterias es una característica diagnóstica importante, para su determinación se utiliza la tinción de Ziehl-Neelsen.
Técnica de tinción para bacterias acidorresistentes
según el método de Ziehl-Neelsen
El papel de filtro se coloca en un frotis fijo y la fucsina carbólica de Ziehl se vierte y se calienta suavemente en un quemador hasta que aparecen los vapores. La operación se repite 2-3 veces.
Cuando la droga se haya enfriado, retire el papel de filtro, drene el tinte y lave la droga con agua.
El medicamento se sumerge 2-3 veces en un vaso con ácido sulfúrico al 5% durante 1-2 segundos.
La preparación se lava a fondo con agua y se tiñe con azul de metileno alcalino durante 3-5 minutos.
Lavado con agua y secado.
Las bacterias resistentes a los ácidos no se decoloran con ácido sulfúrico y conservan su color rojo, las bacterias no resistentes a los ácidos pierden el tinte y se tiñen de azul con azul de metileno.
№18 Inclusiones de bacterias, su composición y función biológica. En el citoplasma hay diversas inclusiones en forma de gránulos de glucógeno, polisacáridos, ácido beta-hidroxibutírico y polifosfatos (volutina). Son sustancias de reserva para las necesidades de nutrición y energía de las bacterias. Volyutin tiene afinidad por los tintes básicos y se detecta fácilmente usando métodos especiales coloración (por ejemplo, según Neisser) en forma de gránulos metacromáticos. La disposición característica de los gránulos de volutina se revela en el bacilo de la difteria en forma de polos de la célula intensamente teñidos. (según Neisser es de color azul oscuro)
№19 Esporas de bacterias, su estructura Algunas bacterias al final del período de crecimiento activo pueden formar esporas. Esto está precedido por el agotamiento del medio ambiente con nutrientes, un cambio en su pH y la acumulación de productos metabólicos tóxicos. Como regla general, una célula bacteriana forma una espora: la localización de las esporas es diferente (central, terminal, subterminal)
Si el tamaño de las esporas no excede el tamaño transversal de una bacteria en forma de bastón, esta última se denomina bacilo (agente causal ántrax). Cuando el diámetro de la espora es mayor, las bacterias tienen forma de huso y se denominan clostridium (agentes causantes de infecciones anaerobias). Los clostridios del tétanos tienen esporas redondas y se asemejan a baquetas. Los Clostridia botulinum se caracterizan por tener grandes esporas ovaladas que les dan la apariencia de una raqueta de tenis.
Según la composición química, la diferencia entre las esporas y las células vegetativas está únicamente en el contenido cuantitativo de compuestos químicos. Las esporas contienen menos agua y más lípidos.
La formación de esporas está asociada con la compactación y el aislamiento de un área determinada del citoplasma de una célula vegetativa, seguida de la formación de un cuerpo redondo u ovalado dentro de la bacteria, cubierto con una densa membrana multicapa, que está saturada con un gran cantidad de lípidos, calcio y ácido dipicolínico (Fig. 12).
Una vez en el cuerpo de humanos y animales, las esporas germinan en células vegetativas. El proceso de germinación de esporas incluye tres etapas: activación, etapa inicial y etapas de crecimiento. Los agentes activadores que alteran el estado latente incluyen temperatura elevada, reacción ácida del medio ambiente, daños mecanicos y otros La espora comienza a absorber agua, se libera del dipicolato de calcio y destruye muchos de sus propios componentes estructurales con la ayuda de enzimas hidrolíticas. Después de la destrucción de las capas externas, comienza un período de formación de una célula vegetativa con la activación de la biosíntesis, que termina con la división celular.
Método de tinción de esporas según Ozheshko
Las esporas retienen firmemente la fucsina carbólica y se tiñen de rojo, el citoplasma de las bacterias se decolora con ácido sulfúrico al 5% y, después de teñirse con azul de metileno, se vuelve azul.
№20 Cápsula y microcápsula de bacterias La cápsula es una capa mucosa de la pared celular de las bacterias, que consta de polisacáridos (neumococo) o polipéptidos (ántrax bacilo). La mayoría de las bacterias pueden formar una microcápsula (menos de 0,2 µm de grosor), una macrocápsula bien definida (más de 0,2 µm de grosor) la forman neumococos, Klebsiella, ántrax y algunas otras. En las bacterias patógenas, la cápsula se forma en el macroorganismo; en medios nutritivos artificiales, por lo general se pierde (con la excepción de Klebsiella).
En humanos y animales, la cápsula protege bacteria patogénica de bacteriófagos, fagocitosis y factores de inmunidad humoral, determina la especificidad antigénica de los microorganismos.
Las cápsulas, que tienen una consistencia de gel, no retienen bien el tinte, y los métodos de contraste negativo se usan con mayor frecuencia para detectarlos.
Método de detección de cápsulas Burri-Gins
Las bacterias están teñidas de rojo, las cápsulas sin teñir contrastan con el fondo oscuro del fármaco.
№21 Flagelos bacterianosLos flagelos actúan como un órgano de movimiento que permite que las bacterias se muevan a una velocidad de 20-60 micrones/seg. Las bacterias pueden tener uno (monotrichous) o varios flagelos, ubicados en toda la superficie del cuerpo (peritrichous), o agrupados en haces (lophotrichous).
La localización peritricosa de los flagelos es característica de enterobacterias, patógenos de infecciones anaerobias, tétanos, botulismo; Vibrio cholerae es un monotrico y Pseudomonas es un lofotrico. Algunas especies de espirilla tienen una disposición anfítrica de flagelos. El grosor de los flagelos tiene un promedio de 10 a 30 nm y la longitud alcanza las 10 a 20 micras.
La base del flagelo es un filamento espiral largo (fibrilla), que en la superficie de la pared celular pasa a una estructura curva engrosada: un gancho y se une al gránulo basal incrustado en la pared celular y CPM (Fig. 10) .
Los gránulos basales tienen alrededor de 40 nm de diámetro y constan de varios anillos (un par en bacterias grampositivas, cuatro en procariotas gramnegativas). La eliminación de la capa de peptidoglicano de la pared celular conduce a la pérdida de la capacidad de movimiento de las bacterias, aunque los flagelos permanecen intactos.
Los flagelos están compuestos casi en su totalidad por la proteína flagelina, con algo de carbohidratos y contenido de ARN.
Bajo un microscopio, los flagelos se pueden ver solo después de métodos especiales de grabado e impregnación con sales de plata y mercurio, seguidos de tinción con azul de metileno (método Leffler). Debe tenerse en cuenta que los flagelos son muy sensibles a diversas influencias mecánicas. La presencia de flagelos puede juzgarse indirectamente por la naturaleza direccional del movimiento en la gota "colgante" y "aplastada" en microscopios de campo oscuro y de contraste de fase, o en microscopía de campo claro con el condensador bajado y el diafragma del microscopio parcialmente cubierto.
Tinción de flagelo por el método de Leffler
bajo microscopía producto terminado los flagelos son visibles como estructuras finas parecidas a hilos.
#22 PiliLa superficie de las enterobacterias y varios otros microorganismos está cubierta un número grande(de 10 a varios miles) vellosidades - formaciones filamentosas de naturaleza proteica. Al igual que los flagelos, se construyen a partir de un tipo de proteína, la pilina, cuyas subunidades están organizadas en forma de hilo hueco en el interior y se originan en el CPM. Son más cortos y delgados que los flagelos, su ancho es de 10 a 12 nm y su longitud es de hasta 12 μm.
Las vellosidades son polifuncionales: proporcionan transferencia de genes transmisibles (conjugación), son receptores de fagos, un órgano para que las bacterias se unan a un sustrato nutritivo (adhesión) y participan en el transporte de metabolitos.
Los estreptococos tienen una capa externa de pelos proteicos (fimbria), que se denominan proteína M (proteína M). esta ardilla juega papel importante en los procesos de interacción de las bacterias con el macroorganismo.
№23 Actinomicetos
Representan un grupo peculiar de bacterias que parecen filamentos ramificados pequeños o largos sin septos. La acumulación de hifas se llama micelio. El parecido con los hongos es puramente externo, ya que los actinomicetos tienen un tipo de célula procariótica con una pared celular que no contiene quitina ni celulosa. Los actinomicetos son grampositivos, muchas formas son resistentes a los ácidos, algunos actinomicetos tienen una cápsula alrededor de los filamentos.
El micelio del sustrato se forma como resultado del crecimiento del micelio en el medio nutritivo y el aire, que crece en la superficie del medio (Fig. 19). En los tejidos afectados (forma de tejido), los actinomicetos pueden formar drusas-gránulos, a partir de hilos densamente entrelazados en forma de rayos que se extienden desde el centro y terminan en engrosamientos en forma de matraz.
Los actinomicetos se multiplican asexualmente, formando conidios o esporóforos con esporangios en los extremos del micelio aéreo. Los portadores de esporas pueden ser rectos, ondulados, en espiral. Esporas: ovaladas, redondas, cilíndricas, con una superficie lisa o con púas, a veces móviles debido a flagelos (zoosporas). Las esporas se utilizan para reproducir actinomicetos, no son resistentes al calor, pero pueden soportar la desecación. Además, es posible la gemación y la fragmentación del micelio en forma de bastoncillos o cocos.
Los actinomicetos están ampliamente distribuidos en la naturaleza, viven en el agua, suelos ricos en humus. Participan en el ciclo de las sustancias en la naturaleza. Tipos separados los actinomicetos se utilizan como productores de antibióticos, vitaminas, lípidos, proteasas, aminoácidos, esteroides.
Los actinomicetos pertenecen al orden Actinomycetales, que incluye las familias: Actinomycetaceae, Nocardiaceae, Streptomycetaceae, Mycobacteriaceae.
Las especies patógenas para los humanos se encuentran entre los representantes de las familias Actinomycetaceae y Nocardiaceae. Los primeros parecen bastones ramificados largos o cortos que no forman micelio aéreo. Son los agentes causantes de la actinomicosis humana y forman drusas en los tejidos afectados.
Los representantes de la familia Nocardiaceae se parecen a las micobacterias, tienen células filamentosas y forman micelio aéreo y de sustrato en medios nutritivos. Las hifas se fragmentan en células cocoides y en forma de bastón. La nocardia patógena causa nocardiosis.
Métodos de búsqueda. teñido según Gram y Ziehl-Neelsen. La drusa se extrae del material patológico con un asa, se coloca en una gota de agua sobre un portaobjetos de vidrio, se presiona ligeramente con un cubreobjetos, luego se introduce una gota de una solución alcalina de azul de metileno debajo del vidrio y se observa al microscopio, contraste de fase. puede ser usado.
№24 espiroquetas
Bacterias espiralmente enrevesadas con motilidad activa. Las dimensiones de las espiroquetas varían en grosor de 0,1 a 0,3 micrones, en longitud de 7 a 500 micrones. Varios movimientos, desde helicoidal hasta de flexión. El examen con microscopio electrónico permitió distinguir en las espiroquetas un cilindro protoplásmico (cuerpo celular), un hilo axial (soporte) y una cubierta exterior de tres capas. El filamento axial está ubicado en el espacio periplásmico entre la cubierta exterior y el cilindro protoplásmico y consta de fibrillas individuales (endoflagellas), cuyo número varía en diferentes especies: en treponema y leptospira - 3-4; en borelia - hasta 30. Cada una de las fibrillas (endoflagelos) se fija en el área de los discos de unión en los extremos del cilindro protoplásmico y se extiende hacia su extremo opuesto, envolviéndolo y terminando libremente. La composición química de las fibrillas es similar a la de los flagelos (Fig. 20).
El cilindro protoplásmico contiene: nucleoide, ribosomas, mesosomas, inclusiones. La cubierta exterior (pared celular) contiene una fina capa de peptidoglicano, es elástica y no tiene rigidez. Estas bacterias no forman endosporas, cápsulas y exflagelados, son gramnegativas, se disponen aleatoriamente en el frotis.
Las espiroquetas pertenecen al orden Spirochaetales, la familia Spirochaetaceae, que incluye tres géneros:
Borrelia: tiene de 3 a 10 rizos inclinados desiguales, los extremos son puntiagudos, de 10 a 30 micrones de largo. El movimiento es entrecortado, según Romanovsky-Giemsa, están pintados en azul. púrpura(representante Borreliarecurrentis - causa fiebre recurrente epidémica; Borreliaburgdorferi - causa la enfermedad de Lyme).
Treponema: tiene 8-14 rizos fuertemente retorcidos de igual amplitud, longitud 5-15 micrones. El movimiento es suave, lento con rotación alrededor del eje longitudinal, según Romanovsky-Giemsa, están pintados en pálido color rosa(un representante de Treponemapallidum - el agente causante de la sífilis).
Leptospira: tiene hasta dos docenas de pequeños rizos frecuentes que terminan en un gancho con un engrosamiento en forma de botón, de 5 a 15 micrones de largo. El movimiento es muy activo, movimiento de traslación hacia adelante, flexión y rotación alrededor del eje. Según Romanovsky-Giemsa, se tiñen débilmente en un color lila rosado (un representante de Leptospirainterrogans es el agente causante de la leptospirosis).
Métodos de búsqueda. En estado vivo, las espiroquetas se estudian en un microscopio de contraste de fase y un microscopio de campo oscuro, observando el activo movimiento característico espiroquetas, características de su forma.
Las preparaciones se preparan según Burri (los filamentos ondulados claros de espiroquetas se hacen visibles sobre un fondo oscuro de la preparación), se tiñen según Romanovsky-Giemsa, según el método de Morozov.
#25 Rickettsia
clase " alfaproteobacterias"
Orden Rickettsiales
Familia Rickettsiaceae
Género Rickettsia
Familia Ehrlichiaceae
Las rickettsias tienen formas diversas y se dividen en los siguientes tipos:
cocoide de grano único (hasta 0,5 micras);
en forma de varilla de dos granos (1-1,5 micras);
bacilar tres-cuatro-granular (3-4 micras);
filiforme multigrano (10-40 micras).
Los granos (nucleoproteínas) se detectan mediante tinción según Romanovsky-Giemsa. Todas las formas son recíprocas. Estructuralmente, tienen todos los componentes de una célula bacteriana: pared celular, cápsula lipoide, citoplasma, nucleoide, ribosomas, pilosidades. Las rickettsias contienen ADN y ARN, tienen alto contenido fosfolípidos, bajo contenido en carbohidratos.
En la mayoría de los casos (excepto en la especie Rochalimaeaguintana), las rickettsias no crecen en medios nutritivos artificiales. El ciclo de vida de la rickettsia depende de la actividad vital de la célula huésped y consta de dos etapas: vegetativa y de reposo (cuerpos elementales). Las Rickettsias que están en estado vegetativo (Fig. 23) se multiplican activamente por fisión binaria y tienen movilidad activa, aparentemente debido a estructuras flagelares. Las rickettsias de la etapa de reposo (cuerpos elementales) son esféricas e inactivas.
Métodos de búsqueda. Las rickettsias están bien teñidas según Romanovsky-Giemsa en color lila, según Morozov (por el método plateado) en negro. Para diferenciar la rickettsia, el método de tinción propuesto por P.F. Zdrodovsky:
Las rickettsias se tiñen de rojo rubí y se detectan fácilmente en el contexto del citoplasma azul y el núcleo celular azul.
№26 Clamidia
clase Clamidia
Orden clamidias
Familia Clamidiáceas
Género: Chlamydia
1). Los cuerpos elementales son estructuras esféricas pequeñas (0,2-0,5 μm) densas en electrones, desprovistas de actividad de metabolitos, que tienen un nucleoide compacto y una pared celular rígida, que se filtran a través de filtros bacterianos. Son el comienzo infeccioso de la clamidia y aseguran su supervivencia en el medio extracelular y la infección de nuevas células.
2). Los cuerpos reticulares son formaciones esféricas más grandes (0,8-1,5 micras) que tienen una estructura de malla con una pared celular delgada y un nucleoide fibrilar. Crecen a partir de cuerpos elementales dentro de las células, carecen de infectividad y, al dividirse, aseguran la reproducción de la clamidia. De ahí otro primer nombre histórico de los cuerpos reticulares: "cuerpo inicial". Los cuerpos reticulares son la forma vegetativa de la clamidia.
3). Los cuerpos intermedios son una etapa intermedia entre los cuerpos elementales y reticulares.
El ciclo de vida de la clamidia comienza con el hecho de que los cuerpos elementales son fagocitados por la célula huésped y luego, en unas pocas horas, se reorganizan, aumentan de tamaño y se convierten en formas reticulares que se multiplican por división transversal. El ciclo de vida termina cuando las formas intermedias emergentes se compactan, reducen de tamaño y se convierten en cuerpos elementales. Al reproducirse dentro de las vacuolas citoplasmáticas, las clamidias forman microcolonias (inclusiones) rodeadas por una membrana. Las tres etapas del desarrollo de la clamidia se encuentran en la composición de las microcolonias. Después de la ruptura de la pared de la vacuola (vesículas) y la membrana de la célula huésped, se liberan las clamidias recién formadas y los cuerpos elementales, que infectan a otras células, repiten el ciclo de desarrollo. En condiciones óptimas de crecimiento en células eucariotas ciclo vital la clamidia es de 17 a 40 horas (Fig. 24).
La peculiaridad de la clamidia también se manifiesta en la estructura de su pared celular. Está desprovisto de peptidoglicano y es una membrana de dos capas, cuya rigidez está determinada por péptidos entrecruzados con puentes disulfuro. De lo contrario, las clamidias se parecen a las bacterias Gram-negativas, ya que contienen glicolípidos similares a los lipopolisacáridos.
El orden Chlamydiales incluye una familia, Chlamydiaceae, con un solo género, Chlamydia. Para los humanos, las especies patógenas son C.trachomatis, C.psittaci, C.pneumoniae. La clamidia causa enfermedades oculares, respiratorias y sistemas urogenitales y unirnos bajo nombre común"clamidia".
Métodos de búsqueda. Para la detección microscópica de cuerpos de inclusión (microcolonias) de clamidia en células infectadas (tejidos), se utilizan varios métodos de tinción: Romanovsky-Giemsa, Macchiavello y otros. Cuando se tiñen según Romanovsky-Giemsa, adquieren un color azul o púrpura. Además, la clamidia es claramente visible en estado no teñido cuando se microscopía de preparaciones húmedas bajo vidrio utilizando un sistema óptico de contraste de fase. EN Últimamente la reacción de inmunofluorescencia directa más utilizada, la tinción con naranja de acridina.
№27 Micoplasmas clase Mollicutes
Orden Mycoplasmatales
Familia micoplasmatáceas
Género Mycoplasma
Género Ureaplasma
Cinco especies son patógenas para los humanos: METRO . neumonía , METRO . Hominis , METRO . genitalium , METRO . incógnito Y tu . urealítico .
micoplasmas- los procariotas más pequeños (125-150 nm) capaces de reproducirse de forma independiente. Se cree que los micoplasmas son los descendientes más cercanos de las células procariotas originales. El genoma de los micoplasmas es mínimo para una célula, es cinco veces más pequeño que el genoma coli y es 0.45 MD. La principal característica de los micoplasmas es la ausencia de pared celular. Están rodeados por una capa similar a una cápsula, debajo de la cual solo hay una membrana delgada de tres capas de 7,5-10 nm de espesor, que contiene una cantidad significativa de colesterol. Como resultado, los micoplasmas se aíslan en un departamento especial Tenericutes, clase Mollicutes ("piel delicada"), orden Mycoplasmatales.
Debido a la ausencia de una pared celular, los micoplasmas (Fig. 21) son osmóticamente sensibles y tienen una variedad de formas:
a) pequeñas células esféricas u ovoides de 0,2 µm de tamaño (cuerpos elementales) que se filtran a través de filtros bacterianos;
b) esféricos más grandes, de hasta 1,5 micras de tamaño;
c) células ramificadas filamentosas de hasta 150 micras de tamaño.
Los micoplasmas no forman esporas, flagelos, algunas especies tienen movilidad deslizante.
Se reproducen por fisión binaria de células esféricas y filamentosas, brotación y liberación de muchos cuerpos elementales formados en filamentos.
En cuanto a la energía, los micoplasmas la obtienen de la forma habitual para los anaerobios facultativos, mediante la fermentación de carbohidratos o aminoácidos. Debido al pequeño genoma de los micoplasmas, tienen capacidades biosintéticas limitadas y deben cultivarse en medios nutritivos enriquecidos con lípidos, proteínas y precursores de ácidos nucleicos. Crecen lentamente, colonias con un centro denso creciendo en el medio, asemejándose a un “huevo frito” (centro oscuro y periferia calada más clara). El tamaño de las colonias es pequeño, no superando las 600 micras.
En la patología humana, varios representantes del género Mycoplasma juegan el papel más importante: M.pneumoniae, M.hominis, M.anthritidis y la única especie del género Ureaplasma–U.urealyticum (llamado así por la actividad de la ureasa). Los micoplasmas patógenos causan enfermedades (micoplasmosis) del tracto respiratorio, urogenital y articulaciones con una variedad de manifestaciones clínicas. Al tratar estas enfermedades, se debe recordar que los micoplasmas no son sensibles a los antibióticos betalactámicos y otros fármacos que inhiben la síntesis de la pared celular (debido a su ausencia en el patógeno).
Métodos de búsqueda. En un microscopio óptico, solo se encuentran las formas más grandes de micoplasmas. En estado vivo, se estudian en un microscopio de campo oscuro y de contraste de fase, los componentes ultraestructurales se detectan mediante microscopía electrónica.
№28 Hongos
Clases (7): · basidiomicetos(champiñones). · Zygomycetes (género Mucor - mucormicosis de humanos y animales) ascomicetos (marsupiales, géneros Aspergilo , Penicillium , hongos de levadura) Deuteromicetos - hongos imperfectos, no se reproducen sexualmente ( cándida )
Los hongos son un gran grupo de organismos que se está desarrollando con éxito, incluidas unas 80.000 especies identificadas. Sus tamaños varían desde levadura unicelular hasta grandes somormujos, bejines y cuernos. Los hongos ocupan una variedad de hábitats, tanto en el agua como en la tierra. Además, son importantes en relación con el papel que desempeñan en la biosfera y en relación con el hecho de que los humanos los utilizan en la medicina y en la economía.
Métodos de búsqueda. Tanto las preparaciones nativas (sin teñir) como las teñidas se preparan para el examen microscópico.
Estudio de preparaciones sin teñir
Para distinguir más claramente los elementos del hongo, se aclara la preparación, para esto se coloca el material patológico (costras, pedazos de la uña, cabello, raspaduras de las membranas mucosas, el contenido de focos granulomatosos) reloj de cristal o una placa Petri, donde se vierte una solución de sodio o potasio cáustico al 10-15% y se coloca en un termostato a 37 0 C durante 20-30 minutos. Luego se retira el material y se coloca en una gota de solución de glicerol al 50% sobre un portaobjetos de vidrio y se cubre con un cubreobjetos, microscópicamente en un microscopio óptico o de contraste de fase. Se puede utilizar otro método: se aplica una gota de glicerina con la adición de potasio cáustico al 10% sobre el material patológico y se examina después de 4-5 minutos, cubierto con un cubreobjetos.
El pus de los abscesos, el contenido de las úlceras y el esputo se diluyen con solución salina fisiológica o agua-alcohol (1:1) o una solución acuosa de glicerol al 50 %, se prepara una preparación de “gotas trituradas” y se examina a x200, x400 aumentos usando contraste de fase.
Estudio de preparaciones teñidas
A partir de pus, sangre, líquido cefalorraquídeo, sedimentos de lavados bronquiales y orina, se preparan frotis finos, que se fijan en una mezcla de Nikiforov, Carnoy, alcohol-formol, se secan y se tiñen:
Colorante lactofucsina que contiene fucsina agria - 0,1 g, ácido láctico - 100 ml. Teñido durante 3-5 minutos. El fondo de la droga es rosa, el micelio es opalescente en azul. Los hongos se tiñen bien con mucormicosis y aspergilosis.
№29 Levadura y similares a levaduras Las células de levadura tienen una forma redondeada, pial o alargada, de 8 a 10 micras de tamaño, con una membrana de dos circuitos. En el citoplasma se observan inclusiones en forma de gránulos de glucógeno, volutina y lípidos. La reproducción se produce por gemación y ascosporas. Las levaduras tipo levadura son similares a las levaduras verdaderas, la diferencia es la ausencia de ascosporas y la capacidad de formar pseudomicelio. Con la formación de pseudomicelio, las células se alargan y se tocan por una base estrecha. Provocan candidiasis, que se desarrollan en personas enfermas con una fuerte disminución de la resistencia corporal y el uso prolongado de antibióticos. Métodos para estudiar la levadura.
El período moderno del estudio de la diversidad biológica se caracteriza por el desarrollo intensivo de la sistemática filogenética, que tiene como objetivo reconstruir caminos específicos del desarrollo histórico de los organismos. En microbiología, la sistemática filogenética recibió un poderoso impulso para el desarrollo solo a fines del siglo XX. en relación con el estudio comparativo de secuencias de nucleótidos conservadas en rRNA. En levadura, esta taxonomía se basa principalmente en el estudio de dos regiones de rDNA con una longitud de alrededor de 600 pares de nucleótidos: el dominio D1/D2 en el extremo 5' del gen que codifica 26S rRNA y la región espaciadora transcrita interna (ITS) , que incluye el gen rRNA 5.8S. Se cree que debido al conservadurismo de estas regiones, las diferencias entre ellas son directamente proporcionales a la distancia filogenética, el grado de relación evolutiva. La secuenciación de secuencias de rDNA no cleotidianas resultó ser una poderosa herramienta para construir una clasificación filogenética de levaduras y determinar su lugar en el sistema general de hongos.
Hasta la fecha, las secuencias de nucleótidos del ARNr se han descifrado y colocado en bancos de datos informáticos disponibles en Internet en representantes de todos los países. especies conocidas levadura. Esto permite construir árboles filogenéticos que reflejen la evolución de sus genes ribosómicos. Resultó que la agrupación de levaduras basada en la similitud de las secuencias de nucleótidos del ARNr en muchos casos no coincide con la agrupación según los rasgos fenotípicos. Muchos de los rasgos tradicionales utilizados en la clasificación de levaduras, como las características de propagación vegetativa, la forma de las ascosporas, la fermentabilidad y la asimilación de azúcar, se han considerado poco fiables e inadecuados para determinar las relaciones filogenéticas. La secuenciación de rRNA (rDNA) ahora se considera esencial cuando se describen nuevas especies de levadura.
Una influencia particularmente fuerte en el estudio de la levadura, así como la mayoría de los otros grupos de microorganismos, tuvo un rápido desarrollo a fines del siglo XX. Biología Molecular. En la taxonomía moderna de la levadura, se utilizan ampliamente métodos de sistemática genética basados en la comparación directa de genomas y la secuenciación de secuencias de nucleótidos. El uso de métodos biológicos moleculares unificados hizo posible acercar aún más los enfoques a la taxonomía de la levadura y los hongos filamentosos, establecer vínculos entre los anamorfos de levadura y los teleomorfos filamentosos, y desarrollar nuevos criterios para crear un sistema filogenético unificado para todo el reino Mycota. . Al mismo tiempo, nuevos conocimientos dieron lugar a nuevos problemas científicos en particular, el problema de la correlación entre los últimos métodos moleculares y los métodos tradicionales basados en enfoques morfológicos y fisiológicos para el estudio de la levadura. El genoma de Saccharomyces cerevisiae ha sido descifrado casi por completo, lo que abre grandes perspectivas para la genómica de levaduras y nuevos horizontes para su uso biotecnológico. Por lo tanto, la ciencia de la levadura, después de haber viajado más de un siglo y medio, continúa desarrollándose rápidamente en el siglo XXI.
Tanto las preparaciones nativas (sin teñir) como las teñidas se preparan para el examen microscópico. Para estudiar hongos en tejidos, se realiza un examen patohistológico.
micelio de esporas de levadura celular
30. Morfología y métodos de investigación de hongos filamentosos. Hay 2 tipos de crecimiento en hongos: crecimiento de hifas (hifomicetos) y crecimiento de levaduras (blastomicetos). Normalmente, el cuerpo vegetativo de los hongos filamentosos consta de filamentos de unos 5 µm de espesor, muy ramificados y llamados hifas. Las hifas no tienen tabiques transversales (en hongos inferiores) o están separadas por tabiques (tabiques) en células (en setas altas). La pared celular puede ser de varios espesores, el bypass a menudo es claramente visible; entre las inclusiones en el citoplasma, las más características son los granos de volutina, glucógeno, pigmento de melanina. Las células fúngicas viejas y maduras son ricas en lípidos. El núcleo contiene un nucléolo y una red de cromatina; las células pueden ser multinucleadas. La colección de hifas forma un micelio (micelio). El micelio puede ser sustrato, formado como resultado del crecimiento de hifas en el medio nutritivo, y aire, que crece en la superficie del medio. El micelio representa los tubos que se ramifican, la ramificación se lleva a cabo por las excrecencias laterales de las hifas. Los filamentos de micelio a veces están dispuestos en filas paralelas, muy cerca unos de otros, asemejándose a una "mecha", de ahí el nombre de "koremia" (en dermatofitos).
31. Principios básicos de clasificación y morfología de los protozoos. Métodos de su investigación y significado médico.
Los protozoos son eucariotas unicelulares, de estructura similar a las células de los animales de organización compleja. La forma puede ser en forma de pera (Trichomonas, Giardia), ovoide (Balantidia), en forma de huso (Trypanosoma, Leishmania), puede adoptar la configuración más extraña (ameba)
La mayoría de los protozoos son móviles y el movimiento se lleva a cabo con la ayuda de pseudópodos (ameba, plasmodio palúdico), flagelos (giardia, leishmania), cilios (balantidia).
seudópodos- protuberancias temporales del citoplasma, liberando que los protozoos cambian la forma del cuerpo todo el tiempo.
Los más simples pertenecen al reino Protozoa (protos - el primero, zoa - animales). De importancia médica son:
Filo Sarcomastigophora, subfilo Sarcodina (Sarcodidae). Su cuerpo está desprovisto de película, se mueven con la ayuda de pseudópodos. Esta clase incluye diferentes tipos ameba, incluida la ameba disentérica (Entamoeba histolytica).
Métodos de búsqueda. Para el estudio de los protozoos, se preparan preparaciones temporales y permanentes (teñidas). Las preparaciones temporales se preparan por el método de "gota triturada" o "gota colgante" con la adición de agua tibia salina psicológica o colorantes intravitales vitales. A partir de la sangre se preparan preparaciones de "gota gruesa". Para hacer esto, el dedo tratado con éter se gira hacia abajo con un pinchazo y se lleva un portaobjetos de vidrio a las gotas que sobresalen, en el que se extraen 2-3 gotas de sangre, y luego se distribuye la sangre con una aguja o la esquina de otro portaobjetos de vidrio para obtener un óvalo de aproximadamente 1 cm, para acelerar el secado de la droga, se puede colocar en un termostato a 35-37 0 C.
Para detectar quistes, se usa una solución fuerte de Lugol, que tiñe las estructuras de los quistes en un color marrón oscuro.
Teñido con hematoxilina férrica según el método de Heidenhain
Los frotis después de la fijación se colocan en una solución al 2,5% de alumbre férrico durante 1 hora.
Después de enjuagar tres veces con agua, teñir con un colorante (0,5 g de hematoxilina, 10 ml de alcohol 96 0 y, después de la disolución, agregar 90 ml de agua destilada) durante 5 a 10 minutos.
Lavado con agua y secado.
La coloración es indispensable en los casos en que es necesario revelar los detalles más finos de la estructura del núcleo y el citoplasma de los protozoos.
Las paredes celulares de las plantas tienen una fuerza extraordinaria y, en el proceso de crecimiento, las plantas cambian su estructura y composición. Los principales componentes de las paredes celulares vegetales son los polisacáridos, entre los que predomina la celulosa, que determina en gran medida la arquitectura de la pared.
Celulosa. Este homopolisacárido es el carbohidrato más común en la Tierra (las plantas forman hasta 1011 toneladas de celulosa al año). Los monómeros de celulosa son residuos de glucosa conectados en cadenas largas (hasta 10 000 residuos de glucosa en cada una) mediante enlaces b (1 → 4) -glucosídicos (fig. 5.3). En tal molécula, no hay libertad completa de rotación alrededor de los enlaces 1C-O- y O-4C, y el polímero adquiere una conformación favorable para la formación de enlaces de hidrógeno entre cadenas cuando las cadenas están dispuestas en forma antiparalela. Como resultado, las moléculas de celulosa se combinan en microfibrillas de 10 a 25 nm de espesor. Las microfibrillas se entrelazan y forman hilos finos, que, a su vez, pueden enrollarse unos alrededor de otros, como los hilos de una cuerda, formando macrofibrillas. Cada macrofibrilla tiene un grosor de aproximadamente 0,5 µm y puede alcanzar una longitud de 6 a 8 µm. La fuerza de las macrofibrillas es comparable a la fuerza de un alambre de acero del mismo grosor. Además, secciones separadas las microfibrillas tienen una estructura ordenada y dan a la pared celular propiedades cristalinas. Así, se puede notar la complejidad y el alto orden de la celulosa en la composición de las paredes celulares, lo cual no es casualidad: este polímero cumple funciones protectoras y de sostén en la planta.
De esta forma, los polisacáridos son inaccesibles a la acción de sus propias enzimas, y la planta no puede utilizar la celulosa como sustancia de reserva. Solo unos pocos organismos (algunas bacterias, hongos, protozoos y animales raros) tienen sistemas enzimáticos capaces de descomponer la celulosa.
Las microfibrillas y macrofibrillas de celulosa de la pared celular de las plantas están sumergidas en matriz, que también se compone principalmente de polisacáridos y cambia su estructura durante el crecimiento de la planta. En primeras etapas matriz de desarrollo consiste en sustancias de pectina, y posteriormente aparecen en él xilanos y varios polisacáridos neutros ("hemicelulosa"). Las sustancias de pectina son polímeros de ácido a-galacturónico, en los que algunos átomos de hidrógeno se reemplazan por grupos metilo (-CH 3) (Fig. 5.3). Los xilanos son polímeros de xilosa (Figura 5.3).
En etapas posteriores del desarrollo, cuando ocurre la lignificación de las paredes celulares, lignina- polímero químicamente resistente que contiene Número grande anillos aromáticos. Además, pequeñas cantidades de glicoproteínas, polímeros lipídicos insolubles, se encuentran en la composición de las paredes celulares de las plantas. estructura diferente y ceras.
Las paredes celulares de algunas plantas contienen polisacáridos raros con una estructura inusual. Por ejemplo, en las paredes e intercelular
La sustancia de las algas rojas marinas contiene un agar heteropolisacárido complejo, que es una mezcla de polisacáridos sulfatados: agarosa y agaropectina. La agarosa se construye a partir de residuos alternos de D-galactosa y 3,6-anhidro-L-lactosa unidos alternativamente por enlaces b(1→4) y a(1→3). La agaropectina tiene más Estructura compleja: Contiene D-galactosa, 3,6-anhidrogalactosa, ácidos urónicos y sulfato. El agar se utiliza como el compactador más común para medios sólidos, indispensable en microbiología, así como en Industria de alimentos para productos gelificantes. Cabe señalar que la gran mayoría de los microorganismos no pueden descomponer el agar, y esta es una de sus principales ventajas sobre otro compactador de medios nutrientes: la gelatina. Hallazgos de agarosa aplicación amplia en investigación bioquímica: ella ambiente acuático forma un gel con poros grandes, cuyo tamaño está determinado por su concentración. Los geles de agarosa se utilizan para el fraccionamiento de proteínas y ácidos nucleicos, así como para la inmovilización celular.
- 20.44 KbPared celular, estructura, composición química. Cambios en la pared celular.
La presencia de un caparazón fuerte. característica una célula vegetal que la distingue de una célula animal. El caparazón le da a la célula una cierta forma y fuerza y protege los contenidos vivos: el protoplasto y, sobre todo, el plasmalema, fuertemente presionados contra el caparazón desde el interior. Cultivadas en medios nutritivos especiales, las células de plantas superiores, en las que la membrana se elimina por el método enzimático, siempre toman una forma esférica. Sin cubierta, la existencia de una célula vegetal en condiciones normales es imposible, ya que la presión de turgencia que le es propia, equilibrada por la contrapresión de la cubierta, conduciría inevitablemente a la ruptura del plasmalema y destrucción del protoplasto. La totalidad de las paredes celulares en la composición del cuerpo de una planta terrestre, que se eleva por encima de la superficie del suelo y no tiene un esqueleto interno, es una especie de armazón de soporte que le da resistencia mecánica a la planta.
El caparazón, por regla general, es incoloro y transparente, transmite fácilmente la luz solar. El agua y las sustancias disueltas de bajo peso molecular pueden moverse a lo largo de él. Cada celda tiene su propio caparazón; las conchas de las células vecinas están, por así decirlo, cementadas por sustancias intercelulares que forman la llamada lámina mediana. Como resultado, las celdas vecinas están separadas entre sí por una pared formada por dos capas y una placa intermedia, lo que da razón para llamar a la capa también pared celular.
El caparazón está construido por el protoplasto de la célula y, por lo tanto, solo puede crecer al estar en contacto con él. Muy a menudo, el caparazón persiste más tiempo que el protoplasto (cuando la célula muere antes de tiempo), pero esto generalmente no conduce al cese de la existencia de la célula como unidad estructural, porque la forma de la célula no cambia debido a la fuerza de la concha. Por lo tanto, incluso después de la muerte, las células vegetales pueden realizar importantes funciones de transporte de soluciones o soporte mecánico. Muchos tipos de células vegetales (fibras, traqueidas, segmentos vasculares, células de corcho) en el estado adulto son una membrana celular. La mayor parte de la madera consiste en caparazones de células muertas.
Las membranas celulares son tan diversas como las propias células. La composición y estructura de la membrana a menudo se puede utilizar para juzgar el origen y la función de las células de varios tipos. Así, la estructura de las plantas fósiles se estudia principalmente estudiando las membranas de sus células.
Inicialmente, la pared celular primaria surge hacia afuera del plasmalema. Se compone de polisacáridos - pectina y celulosa. Las paredes celulares primarias de las células vecinas están conectadas por una lámina mediana de protopectina. En la pared celular, las moléculas de celulosa lineales y muy largas, que consisten en glucosa, se ensamblan en paquetes, micelas, que, a su vez, se combinan en fibrillas, las fibras más delgadas de longitud indefinida. La celulosa forma un esqueleto multidimensional, que se encuentra inmerso en una matriz amorfa muy acuosa de carbohidratos no celulósicos: pectinas, hemicelulosas, etc. Es la celulosa la que determina la resistencia de la pared celular. Las microfibrillas son elásticas y tienen una resistencia a la tracción similar a la del acero. Los polisacáridos de la matriz determinan propiedades de la pared tales como una alta permeabilidad al agua, pequeñas moléculas e iones disueltos y un fuerte hinchamiento. Gracias a la matriz, el agua y las sustancias pueden moverse de una célula a otra a lo largo de las paredes adyacentes entre sí. Algunas hemicelulosas pueden depositarse en las paredes celulares de las semillas como sustancias de reserva.
El material de la cubierta, incluida la celulosa, es ampliamente utilizado por la industria. Las propiedades de la madera, el papel y los materiales textiles dependen en gran medida de la estructura molecular y la composición química de la cubierta, y su conocimiento ayuda a mejorar la tecnología de producción y la calidad del producto.
Composición química y organización molecular de la concha. La membrana celular está construida principalmente de polisacáridos, cuyos monómeros, azúcares, están interconectados por un enlace glucosídico (-O-) en forma de cadena. Los polisacáridos se nombran según la composición de los monómeros que los forman, con la adición de la terminación "an". Por ejemplo, el polisacárido xilano consiste en residuos de azúcar xilosa, manano - manosa, glucano - glucosa, etc.
Además de los polisacáridos, la composición de la cubierta puede incluir proteínas, sales minerales, lignina, pigmentos, lípidos. Por lo general, las conchas están impregnadas de agua. Los polisacáridos de la cubierta, según su función, se pueden dividir en sustancias del esqueleto y sustancias de la matriz. La sustancia esquelética de la concha. plantas superiores es celulosa (fibra), que representa químicamente β-1, glucano 4-D. El número de residuos de glucosa en una molécula y, en consecuencia, la longitud de las propias moléculas puede variar drásticamente en las paredes celulares de diferentes plantas, lo que afecta las propiedades de la celulosa. Sus moléculas filamentosas en el caparazón están dispuestas paralelas entre sí y se agrupan por varias decenas de tal manera que aparece una red tridimensional alargada, característica de los cristales. Estos grupos cristalinos, en cuya formación están involucrados los enlaces covalentes y de hidrógeno, forman la base de las microfibrillas, las fibras más delgadas que crean el marco estructural de la cubierta, su "refuerzo".
El estado cristalino de las moléculas de celulosa en las microfibrillas determina la birrefringencia de la pared celular, que se observa en un microscopio polarizador. En las microfibrillas, hay regiones paracristalinas, es decir, regiones con una disposición paralela más suelta, pero que no tienen una orientación tridimensional, de moléculas de celulosa. El grado de cristalinidad de las microfibrillas, la proporción de zonas cristalinas y paracristalinas varían bastante según el tipo de planta, el estado de la célula y el tipo de cubierta, lo que afecta a las celulosas mecánicas y físicas como materia prima. El diámetro de las microfibrillas también varía en diferentes células (generalmente dentro de 10-30 nm), la longitud puede alcanzar varios micrómetros. Las microfibrillas se pueden combinar en grupos o capas separadas: macrofibrillas con un grosor de 0,4-0,5 micrones, visibles en un microscopio óptico.
Figura 25
Durante la vida de las células, especialmente dependiendo del desempeño de alguna función especializada, ocurren cambios secundarios en la pared celular. A menudo se asocian con cambios radicales en su composición química, estructura y propiedades fisicoquímicas.
Madera. La pared celular está incrustada (impregnada) con una sustancia especial, la lignina, que aumenta la dureza, el contenido calórico, la densidad de la pared celular y reduce su plasticidad y capacidad de crecimiento. Las paredes celulares lignificadas no pierden su capacidad de pasar agua y aire. Su protoplasto puede permanecer vivo, aunque generalmente muere. La explotación forestal está muy extendida en la naturaleza. Da fuerza a los troncos y ramas de los árboles. La madera de coníferas y frondosas contiene hasta un 50 % de celulosa y un 20...30 % de lignina. Paredes celulares lignificadas y muchas hierbas, especialmente hacia el final de la temporada de crecimiento.
Sondaje o suberinización. Como resultado de la abundante formación de capas en la pared celular de una sustancia químicamente resistente, la suberina, se produce su suberina. Por su naturaleza química, la suberina está cerca de las grasas. Es un compuesto hidrofóbico amorfo, que consta de ácidos grasos saturados de alto polímero e hidroxiácidos complejos. La suberina se deposita principalmente en las paredes celulares del tejido tegumentario secundario: el corcho, que es un excelente aislante térmico y de agua. En pequeñas cantidades, se acumula en las paredes celulares de varios tejidos. Con el encorchado completo, el protoplasto de la célula muere, ya que las láminas de suberina evitan la penetración de agua y aire, con parcial: el protoplasto se conserva durante mucho tiempo.
Mineralización. En el proceso de la vida, las paredes de las células superficiales de los brotes pueden acumular sustancias minerales, especialmente sílice y carbonato de calcio.Algunos grupos de plantas, por ejemplo, muchos tipos de juncias, hierbas, colas de caballo, siempre tienen células del tejido tegumentario. , la epidermis, fuertemente incrustada con sales. Además, no solo se puede incrustar la pared celular, sino también varios crecimientos de la epidermis: tricomas. Además, las sustancias minerales se depositan en la superficie de las células del tejido tegumentario: la epidermis. Como resultado de la mineralización, los órganos axiales adquieren mayor resistencia mecánica.
Adelgazar. La transformación de la celulosa y la pectina en moco y gomas cercanas a ellos, que son carbohidratos poliméricos, que se distinguen por su capacidad de hincharse fuertemente cuando entran en contacto con el agua. El mucílago se observa en las células celulares de la cubierta de la semilla, por ejemplo, en el lino. La formación de moco es de gran importancia adaptativa. Cuando las semillas germinan, la mucosidad las fija en un lugar determinado, absorbe y retiene fácilmente la humedad, evita que las semillas se sequen y mejora el régimen hídrico de las plántulas. El mucílago de las paredes celulares de la raíz vlosk asegura su fuerte unión con las partículas del suelo.
La maceración es la disolución de la sustancia intercelular, que conduce a la separación de las células. La maceración natural se produce en frutos maduros. Se lleva a cabo artificialmente, por ejemplo, cuando el lino es lobulado para liberar las materias primas que giran, grupos de células de fibras bastas.
Descripción del trabajo
La presencia de un caparazón fuerte es un rasgo característico. célula vegetal que la distingue de una célula animal. El caparazón le da a la célula una cierta forma y fuerza y protege los contenidos vivos: el protoplasto y, sobre todo, el plasmalema, fuertemente presionados contra el caparazón desde el interior. Cultivadas en medios nutritivos especiales, las células de plantas superiores, en las que la membrana se elimina por el método enzimático, siempre toman una forma esférica.
