Wyjątkowy na swój sposób zapewnia ich różnorodność i cechy życia.
Nowoczesna mikrobiologia do badań i klasyfikacji wykorzystuje następujące cechy charakterystyczne bakteria:
- Morfologiczna struktura komórkowa:
- kuliste „ziarniaki”;
- „prątki” w kształcie pręta;
- spiralne „krętki”;
- zawiła forma „vibrios”.
- Oddech:
- oddychać tlenem „aerobowo”;
- beztlenowe „beztlenowe”.
- Metoda karmienia:
- autotroficzny „niezależny” - zdolny do syntezy materia organiczna z nieorganicznych za pomocą energii reakcje chemiczne lub fotosynteza (na przykład niebiesko-zielone algi);
- heterotroficzne - przetwarzają i przetwarzają gotowe substancje organiczne, otrzymane w wyniku życiowej aktywności innych organizmów, w tym mikroorganizmy chorobotwórcze (patogenne) i symbiotyczne (korzystne), a także bakterie żyjące w wyniku procesów fermentacji, rozkładu itp. .
- Siedlisko:
- środowisko zewnętrzne (gleba, woda itp.);
- wewnątrz żywych organizmów;
- martwe substancje organiczne (zwłoki, osady, odpady).
- Sposób dystrybucji i przetrwania (czy zarodniki komórek, osłonki, forma śluzu).
- Reakcja na test Grama (separacja ze względu na skład i strukturę ścian, kluczowa klasyfikacja w kontekście tematyki konstrukcji Ściana komórkowa):
- Gram-dodatni - wybarwiony podczas procedury barwienia metodą Grama (powłoka jest przepuszczalna dla barwnika anilinowego (fiolet krystaliczny, fiolet metylowy itp.));
- Gram-ujemne - nie barwią się podczas barwienia metodą Grama (ściana komórkowa jest nieprzepuszczalna dla barwnika).
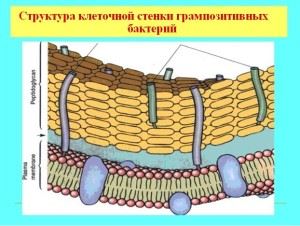
Cechy ściany komórkowej bakterii Gram-dodatnich
Istotą testu (zaproponowanego przez G.K. Grama w 1884 r.) jest procedura obróbki próbki kultury bakteryjnej barwnikiem anilinowym (fiolet krystaliczny, fiolet krystaliczny). Po kolejnym przemyciu alkoholem drobnoustroje Gram (+) zachowują swój niebieski kolor, podczas gdy inne ulegają odbarwieniu. Zdolność ściany komórkowej do wiązania barwnika zależy od składu i struktury ściany komórkowej. Klasyfikacja organizmów jednokomórkowych według typu struktury ściany komórkowej, która może być barwiona lub nie przy użyciu metody Grama, jest jedną z kluczowych. W praktyce wyniki testu Grama pomagają w postawieniu diagnozy choroba zakaźna badanie właściwości biochemiczne mikroorganizmy.
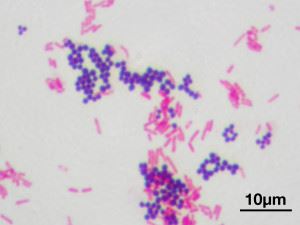
Barwienie metodą Grama. Ziarniaki (kuliste) - Gram-dodatnie i pałeczki (pręciki) - Gram-ujemne
Większość bakterii Gram-dodatnich ma masywną, jednowarstwową błonę przepuszczalną dla barwnika anilinowego. Skład ściany obejmuje złożone cząsteczki organiczne, podstawą sztywności mechanicznej jest mureina (heteropolimer), glikopeptydy, mukopeptydy. Struktura ściany decyduje o kształcie mikroorganizmu i jest czymś w rodzaju zewnętrznego szkieletu, o porowatej strukturze, grubości około 40 cząsteczek glikopeptydu. Oprócz zasady peptydoglikanowej otoczka zawiera kwasy teichojowe i polisacharydy.
Pomimo ogólna reakcja na barwniku wśród organizmów Gram-dodatnich spotkać można organizmy należące do różnych podgatunków, Różne formy, wielkość, siedlisko i sposób żerowania.
Większość bakterii chorobotwórczych dla ludzi jest gra-dodatnich, wśród których na przykład czynniki sprawcze takich chorób zakaźnych:
- tężec (Clostridium tetani),
- zatrucie jadem kiełbasianym (Clostridium botulinum),
- wąglik (),
- paciorkowce,
- gronkowce (Staphylococcus aureus), które są wysoce odporne na temperaturę i działanie leki.
Kwasoodporne, ze względu na specjalną wielowarstwową budowę otoczki (zawiera woski, polisacharydy i białka), z reguły nie barwią się metodą Grama. Dla nich stosowana jest specjalna metoda Ziela-Nelsena. Ale niektórzy dają wynik pozytywny metodą Grama w przypadku bardzo wysokiego stężenia barwnika lub podniesiona temperatura podczas zabiegu.
Jednokomórkowe organizmy kwasoodporne przeżywają w środowisku kwaśnym i środowiska alkaliczne, chociaż środowisko normalne dla ich rozwoju i wzrostu jest neutralne. zwykle klasyfikowany jako Gram-dodatni. Przedstawiciele tej niebezpiecznej dla ludzi i zwierząt grupy są czynnikami sprawczymi takich chorób jak gruźlica i trąd. Kwasoodporne są również niektóre bakterie glebowe zdolne do wiązania azotu atmosferycznego i będące symbiontami roślinnymi.
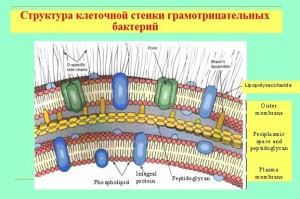
Cechy otoczki bakterii Gram-ujemnych
Chociaż grubość ich ścian mukopeptydowych jest znacznie cieńsza, ściana jest nieprzepuszczalna dla barwnika fioletu krystalicznego. Chodzi o zasadniczo inną budowę i skład chemiczny komórki. Skorupa ma budowę wielowarstwową i składa się z:
- zewnętrzna powłoka (membany), jej głównym składem są liposacharydy i białka;
- Przestrzeń periplazmatyczna;
- warstwa wewnętrzna (peptydoglikan mureinowy) ma skład podobny do ścianek bakterii Gram-dodatnich, ale z reguły jest ponad dwukrotnie cieńsza.
Dzięki więcej złożona struktura niektórzy członkowie tej grupy mają zwiększoną oporność na przeciwciała i antybiotyki.
Wraz z komplikacjami ściany komórkowej pojawiły się nowe funkcje i możliwości. Niektóre rodzaje bakterii, które żyją twarde powierzchnie, nabył zdolność zmiany kształtu komórki (ściany „szkieletu” stały się plastyczne). Jest to ważne podczas ślizgania się i poruszania po nierównościach stałego siedliska.
Przestrzeń peryplazmatyczna nabrała funkcji izolowanego miejsca przechowywania niektórych enzymów hydrolizujących, niezbędnych do życia komórki, ale jednocześnie zdolnych do rozkładania cząsteczek polimeru samej bakterii. W wyniku hydrolizy cząsteczek polimeru wchodzących z zewnątrz żywa komórka rozszerza gamę substancji odpowiednich do odżywiania, jednocześnie nieprzepuszczalna dla enzymów błona wewnętrzna zapobiega „samotrawieniu” komórki bakteryjnej.
W strukturze błony zewnętrznej znajdują się białka, które mogą tworzyć hydrofilowe pory, przez które niektóre makrocząsteczki (cukry i aminokwasy) niezbędne do odżywiania bakterii mogą przedostawać się do komórki.
Ta klasa bakterii obejmuje wiele bakterii, które mogą się zmieniać skład chemiczny siedlisko (bakterie fermentacji octowej i alkoholowej); symbiotyczne - Escherichia coli (E. coli), wiele organizmów chorobotwórczych (chorobotwórczych), takich jak meningokoki (Neisseria meningitidis); legionella (Legionella pneumophila) i słynna Helicobacter pylori wyzywający wrzód trawienny i wysoką kwasoodporność.

Wykorzystanie przez człowieka cech strukturalnych bakterii
Pierwszymi mikroorganizmami, które człowiek wykorzystywał dla swoich potrzeb, były bakterie fermentacji mlekowej i alkoholowej. To oni dla nas gotowali i nadal gotują sery, chleb i wino. Co więcej, ludzie zaczęli wykorzystywać produkt swojej pracy na długo przed odkryciem bakterii i rozpoczęciem badania struktury i składu ich produktów przemiany materii.
Obecnie biologiczne metody oczyszczania ścieków i fekaliów stały się dostępne nie tylko przedsiębiorstwa komunalne ale także do prywatnych właścicieli domów. Uśpione kultury są częścią nowoczesne leki do szamb i kanalizacji lokalnej. Farmy często stosowane kwasoodporne do szybkiego przetwarzania kompostu i odchodów zwierzęcych na nawozy oraz do wielu innych celów.
Ponadto wiele genetycznie zmodyfikowanych bakterii bierze udział w produkcji leków, syntezie nowych rodzajów polimerów i innych materiałów o unikalnych właściwościach. właściwości chemiczne i złożonej strukturze.
Składniki chemiczne ściany komórkowej dzielą się zwykle na zasadowe, inkrustujące i osadzające się na jej powierzchni (adcrusting). Do głównego składniki chemiczne obejmują celulozę, hemicelulozę, pektynę, białka. Składniki inkrustujące ścianę komórkową to lignina i suberyna. Kutyna i wosk mogą osadzać się na powierzchni ściany komórkowej. Ponadto ściany komórkowe zawierają krzemiany i węglany wapnia.
Najczęstszymi składnikami odnawialnych materiałów roślinnych są celuloza, lignina i hemicelulozy (poliozy), których jest ich odpowiednio 40; 30 i 26 proc waga całkowita. Celuloza jest materiałem wzmacniającym ściany komórkowe, tworząc uporządkowane struktury nitkowate (fibryle). Lignina i hemicelulozy są amorficznymi biopolimerami o strukturze sieciowej lub rozgałęzionej i pełnią rolę spoiw (wypełniaczy).
Struktura tych substancji, ich interakcje międzycząsteczkowe determinują właściwości substratów roślinnych jako całości i ich zachowanie podczas przetwarzania.
Celuloza
Celuloza jest najpowszechniejszą substancją na Ziemi, jest szkieletem ściany komórkowej roślin. Najlepiej zbadać strukturę celulozy włókien bawełny i włókien syntetyzowanych przez niektóre bakterie, algi i mięczaki, ponieważ celuloza występuje w nich w najczystszej postaci. W drewnie występuje jedynie w postaci kompozytu z innymi biopolimerami, skąd trudno go wydobyć bez częściowego zniszczenia.
Pod względem chemicznym celuloza jest polisacharydem, którego makrocząsteczki zbudowane są z reszt ß-D-glukozy i reprezentują liniowy łańcuch jednostek anhydroglukopiranozy połączonych wiązaniami 1,4-glukozydowymi (ryc. 9).
Ryc.9. Struktura chemiczna celuloza
Jest to stereoregularny polimer, w łańcuchu którego reszta celobiozy służy jako stereopowtórne ogniwo. Całkowita formuła celulozy ma postać - (C 6 H 10 O 5) n lub [C 6 H 7 O 2 (OH) 3] n. Jednostka monomeryczna celulozy zawiera trzy alkoholowe grupy hydroksylowe, z których jedna jest pierwszorzędowa - CH 2 OH, a dwie przy C 2 i C 3 są drugorzędowe - CHOH. Ogniwa końcowe różnią się od pozostałych ogniw łańcucha. Jedno wiązanie końcowe (przy C4) ma dodatkową, wolną drugorzędową grupę hydroksylową alkoholu. Łącznik końcowy (w C1) zawiera wolny glikozydowy (półacetalowy) hydroksyl i może występować w dwóch formach tautomerycznych - cyklicznej (półacetalowej) i otwartej (aldehydowej). Końcowa grupa aldehydowa nadaje celulozie zdolność redukującą (odbudowującą). Zdolność celulozy do ulegania reakcjom redukcji można wykorzystać do scharakteryzowania długości jej łańcuchów, która jest charakterystyczna dla celulozy ten gatunek rośliny.
W reszcie glukozy zwykle rozróżnia się płaszczyzny hydrofilowe i hydrofobowe, w zależności od tego, ile odpowiada im grup OH i CH. Jest to ważne przy badaniu interakcji reszty glukozy z resztami aminokwasów aromatycznych podczas enzymatycznego rozszczepienia cząsteczki celulozy w centrum aktywnym enzymu.
Ze względu na fakt, że grupy hydroksylowe przy pierwszym i czwartym atomie glukozy różnią się położeniem względem płaszczyzny pierścienia, sąsiednie reszty glukozy w łańcuchu polimeru okazują się obrócone względem siebie o 180 0. Łańcuchy polimerowe są stabilizowane przez wiązania wodorowe powstające pomiędzy resztami glukozy podczas interakcji grup hydroksylowych przy 6,2,3 atomach węgla i pierścieniowego tlenu. Liniowe łańcuchy polimerowe są połączone międzycząsteczkowymi wiązaniami wodorowymi, które powstają między atomami tlenu jednego łańcucha i grupami hydroksylowymi przy C6 glukozy innego łańcucha (ryc. 10). W wyniku takich oddziaływań powstają mocne włókna. Elastyczność cząsteczki celulozy jest określona przez możliwość rotacji reszt anhydroglukozy w wiązaniu celobiozowym względem wiązania glikozydowego. Stabilność liniowej konformacji celulozy jest określona w szczególności przez minimalne odpychanie C1-H i C4-H.
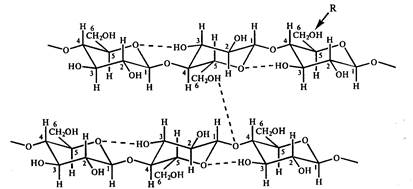
Ryż. 10. Schematyczne przedstawienie układu wiązań wodorowych między resztami glukozy w celulozie. R jest centrum możliwej chemicznej modyfikacji celulozy. Tak więc odpowiednio w metylocelulozie, acetylocelulozie i karboksymetylocelulozie R \u003d CH 3, COCH 3, CH 2 COOHa
Cząsteczka glukozy jest przedstawiona w konformacji krzesła, w której atomy C2, C3, C5 i O5 leżą w tej samej płaszczyźnie, a atomy C1 i C4 leżą po jej przeciwnych stronach. Reszta glukozy może również przyjmować konformacje mniej korzystne energetycznie, które w zależności od stopnia stabilności są ułożone w następującej kolejności: konformacja skośna, konformacja łodzi (lub kąpieli) i najmniej korzystna konformacja półkrzesła, w której 5 atomów 6-członowego pierścienia piranozy spadają jednocześnie do jednej płaszczyzny. Zdolność jednostki anhydroglukozy do przyjmowania w cząsteczce celulozy, oprócz najbardziej stabilnych, mniej stabilnych konformacji (na przykład konformacja łodzi lub konformacja półkrzesła) ma znaczenie z naruszeniem uporządkowanej struktury supramolekularnej celulozy, a także w enzymatycznej hydrolizie wiązań glikozydowych w jej cząsteczce.
Włókna elementarne (micele) celulozy składają się z 100-200 łańcuchów polimerowych połączonych mostkami wodorowymi. Te włókna w ścianie komórkowej są równoległe do siebie i są zgrupowane w taki sposób, że tworzą się owalne wiązki. – mikrofibryle . Około 10 miceli tworzy mikrofibryle o średnicy 0,025 nm (ryc. 11).
Każda wiązka ma centralną część krystaliczną - rdzeń, w którym łańcuchy są upakowane tak ciasno, że nawet cząsteczki wody z trudem się w nie przenikają. Wokół jądra znajduje się kora parakrystaliczna o mniej uporządkowanej strukturze. Te mniej uporządkowane regiony, zwane także regionami amorficznymi, zazwyczaj stanowią około 15% mikrostruktury celulozy. Mikrofibryle mogą się łączyć poszczególne grupy lub warstwy – makrofibryle - o grubości 0,4-0,5 mikrona, widoczne w mikroskopie świetlnym. Średnica i stopień krystaliczności mikrowłókien różnią się dość silnie w zależności od rodzaju rośliny i stanu fizjologicznego komórki.
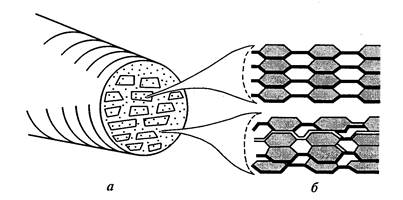
Ryc.11. Model struktury mikrofibryli: a) przekrój poprzeczny mikrofibryli z micelami i przestrzeniami międzykomórkowymi; b) układ celulozowy
Dla miazgi drzewnej o indeksie uporządkowania 50-70% wymiary poprzeczne krystalitów nie przekraczają 4x6 nm. Według mikroskopii elektronowej średnie wymiary średnicy mogą wynosić 1,5-2x2,5-3,5 nm. Od 40 do 80% cząsteczek o takich rozmiarach znajduje się na powierzchni krystalitu, gdzie możliwe jest ich większe uwodnienie, naruszenie uporządkowania dalekiego zasięgu w strukturze wiązań wodorowych, a także silniejszy wpływ wpływów chemicznych.
Naturalna celuloza jest polidyspersyjna, liczba reszt glukozy w cząsteczce celulozy, a co za tym idzie długość samych cząsteczek, może się znacznie różnić w ściany komórkowe różne rośliny. Tak więc w przypadku celulozy z włosów bawełnianych stopień polimeryzacji pierwotnej ściany komórkowej wynosi 2-6 tysięcy, wtórny - 13-14 tysięcy, w przypadku celulozy Acetobacter xylinum - 2-6 tysięcy, w przypadku drewna - 8-10 tysięcy. Maksymalna ustalona eksperymentalnie masa cząsteczkowa celulozy lnianej wynosi 6 000 000. Ze względu na to, że stopień polimeryzacji jest wskaźnikiem średnim, najdokładniejszą charakterystyką jest krzywa rozkładu cząsteczek celulozy na długości (rozkład masy cząsteczkowej). Jednak ta cecha jest trudna do uzyskania i dlatego stosuje się charakterystyki średnie: liczbowo średnie (DP n) i wagowo średnie (DP w) stopnie polimeryzacji. Liczbowo średni stopień polimeryzacji jest równy całkowitej liczbie reszt anhydroglukozy w próbce celulozy podzielonej przez Łączna cząsteczki polimeru. Aby to ustalić, końce redukujące są miareczkowane w próbce polisacharydu. Wagowo średni stopień polimeryzacji celulozy określa się rozpuszczając próbkę celulozy w zasadowym kompleksie miedzi, cynku, kobaltu lub kadmu z etylenodiaminą lub w kompleksie LiCl z N,N'-dimetyloacetamidem. współczynnik DP w/DP N równa się jedności tylko dla polimerów monodyspersyjnych.
Dla miazgi drzewnej świerka, sosny, brzozy i osiki średni wagowo stopień polimeryzacji wynosi 12000, a długość takiej cząsteczki w stanie rozciągniętym sięga prawie 6 mikronów, czyli jest 6000 razy większa niż jej średnica. Tak długa i regularnie zbudowana cząsteczka układa się w określony sposób. Metoda układania określa strukturę supramolekularną biopolimeru, która opiera się na wewnątrz- i międzycząsteczkowych wiązaniach wodorowych tworzonych przez jednostki celobiozy. Badanie metody układania i typów wiązań wodorowych w makrocząsteczce celulozy prowadzi się za pomocą analizy konformacyjnej, dyfrakcji (małokątowe rozpraszanie promieni rentgenowskich, rozpraszanie elektronów), spektroskopii IR oraz NMR. Pomimo znacznych postępów w tej dziedzinie, kwestia sposobu układania cząsteczek celulozy nie została ostatecznie rozwiązana.
Celuloza jest nierozpuszczalna w wodzie i rozpuszczalnikach organicznych, chemicznie obojętna, mechanicznie bardzo wytrzymała. Woda między blisko rozmieszczonymi, ale nie oddziałującymi bezpośrednio powierzchniami krystalitów ma strukturę. Usunięcie wody hydratacyjnej, np. w wyniku suszenia, sprzyja konwergencji początkowo niestykających się ze sobą cząsteczek celulozy i powstawaniu między nimi różnego rodzaju wiązań wodorowych, które nie ulegają zniszczeniu podczas rehydratacji. Naukowcy przypisują wzrost stopnia krystaliczności podczas nawilżania przenikaniu wody z obszarów mniej uporządkowanych do bardziej uporządkowanych. W rezultacie obserwuje się spadek bezwzględnych rozmiarów krystalitów i wzrost stopnia ogólnego uporządkowania. Uważa się, że woda w tym przypadku działa na zasadzie „smarowania molekularnego”, ułatwiając nieuporządkowanym fragmentom cząsteczek uzupełnienie uporządkowanej struktury poprzez kooperacyjne oddziaływanie z krystalicznym „ziarnem”. Zastąpienie polarnych grup celulozy, np. karboksymetylem, prowadzi do naruszenia regularności molekularnej, sprzyja tworzeniu się wielu wiązań wodorowych z wodą i sprawia, że celuloza jest rozpuszczalna.
Odporność celulozy na rozszczepianie, zarówno w warunkach naturalnych, jak i laboratoryjnych, wynika nie tyle z charakterystyki wiązania b-1,4-glukozydowego, ile z krystalicznej struktury celulozy i specjalnego „upakowania” jej cząsteczek w struktury biologiczne.
Enzymy celulolityczne nie mogą przenikać do wewnętrznych struktur włókienek celulozy. Działają na ich powierzchni. Liczba wiązań glikozydowych dostępnych dla działania enzymów zależy w dużej mierze od stopnia spęcznienia celulozy. Zwiększenie stopnia spęcznienia można osiągnąć poprzez obróbkę wstępną – parowanie, mielenie, sonikację itp. Kwasy mineralne i zasady zwiększają pęcznienie całego włókna wysokie stężenia, ponieważ są w stanie rozrywać wiązania wodorowe i przenikać do obszarów krystalicznych. Amorficzne sekcje celulozy są stosunkowo łatwo podatne na działanie kwasów i zasad.
Pod działaniem stężonych roztworów alkalicznych na celulozę zmieniają się jej właściwości fizykochemiczne i strukturalne: obserwuje się intensywne pęcznienie i zmienia się stopień krystaliczności. Frakcja celulozy o dużej masie cząsteczkowej, nierozpuszczalna w 17,5% NaOH, nazywana jest a-celulozą. Bawełna składa się głównie z a-celulozy, podczas gdy inne rośliny i drewno zawierają głównie b-celulozę, rozpuszczalną w stężonym roztworze alkalicznym.
Mikrofibryle są zanurzone w amorficznej matrycy otoczki, która jest złożoną mieszaniną polimerów, wśród których dominują polisacharydy o różnej masie cząsteczkowej. Przyjmuje się, że na powierzchni wszystkich mikrofibryli znajduje się warstwa cząsteczek ksyloglukanu zaabsorbowanych wiązaniami wodorowymi. Lignina i hemicelulozy wypełniają przestrzeń między elementarnymi włóknami celulozy. Zatem zdrewniała substancja jest strukturą polimerową składającą się ze zbrojenia celulozowego zanurzonego w matrycy lignocelulozowej.
Celuloza i hemicelulozy charakteryzują się odmienną kinetyką formowania, na co najwyraźniej wskazuje różne miejsca ich synteza. Wydaje się, że synteza celulozy zachodzi poza komórką na powierzchni błona cytoplazmatyczna z udziałem GDF lub UDF. Donorami grup glikozylowych są difosforany nukleozydów cukrowych, które powstają z glukozy i sacharozy. różne sposoby. Na przykład z trifosforanów nukleozydów i 1-fosforanów cukru z udziałem pirofosforylazy. Reszty glikozylowe są przyłączone do reszt cukrowych na nieredukujących końcach rosnącego łańcucha. Pomiędzy pierwszym atomem węgla „dodanej” reszty a grupą hydroksylową czwartego atomu węgla reszty końcowej powstaje wiązanie glikozydowe z udziałem syntetazy.
N (difosforan nukleozydu) + (cukier) n syntetaza n (difosforan nukleozydu) + (cukier) n +1
W ścianie komórkowej znaleziono enzymy syntezy celulozy i granulki o średnicy 8 nm, które najwyraźniej są wieloenzymatycznymi kompleksami zlokalizowanymi na powierzchnia zewnętrzna plazmalemma i w macierzy ściennej. Syntetaza celulozy (E) w plazmalemmie jest związana z aktywującym białkiem P, które jest zdolne do wiązania GTP i przejścia do postaci aktywnej z utworzeniem kompleksu P-E-GTP.
W procesie syntezy celulozy powstają nie tylko pojedyncze łańcuchy celulozy, ale także mikrofibryle celulozy. Syntetaza taka jest prawdopodobnie prowadzona z udziałem wielu cząsteczek syntetaz celulozy skupionych w odrębnych miejscach plazmalemmy, a syntetazy celulozy składają się z wielu podjednostek, z których każda odpowiada za syntezę pojedynczego łańcucha glukanu. NA wewnątrz błon, znaleziono „rozety” sześciu kulek białkowych. Rozety są wydzielane do plazmalemmy przez system pęcherzyków błony wewnętrznej. Na podstawie cech połączenia strukturalnego rozet, kompleksów końcowych i powstałych mikrowłókien celulozowych przyjęto założenie o mechanizmie powstawania mikrofibryli w komplementarnej strukturze transbłonowej: rozety - kompleks końcowy - rosnący koniec mikrofibryli. Kompleks końcowy jest połączony z końcem nowo zsyntetyzowanej mikrofibryli, a rozety są miejscem wiązania prekursorów celulozy i wydzielania „nośników” reszt glukozy.
Pojedyncze rozety wraz z odpowiadającymi im kompleksami końcowymi są odpowiedzialne za syntezę losowo zorientowanych mikrofibryli pierwotnej ściany komórkowej (ryc. 12), a zorientowany zestaw do 175 rozet w oddzielnych odcinkach plazmalemmy warunkuje powstawanie równoległych mikrofibryle wtórnej ściany komórkowej (ryc. 13).
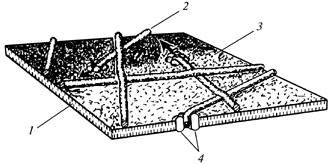
Ryc. 12. Mikrofibryle celulozowe podczas formowania
pierwotna ściana komórkowa: 1
- podwójna warstwa lipidowa; 2
- mikrofibryla; 3
- zewnętrzna powierzchnia plazmalemmy; 4
- gniazdo elektryczne
Każda rozeta tworzy mikrofibrylę o średnicy 5 nm. Odległość między rzędami rozet w błonie plazmatycznej odpowiada odległości między mikrofibrylami w ścianie komórkowej. Cienkie mikrofibryle zawierają około 50 łańcuchów poliglukanowych. Te mikrofibryle tworzą włókienka wtórnej ściany komórkowej, które mogą mieć średnicę do 28 nm. Celuloza, w przeciwieństwie do skrobi, jest trudno metabolizowanym związkiem. Jego strawność zależy od pochodzenia, zawartości w diecie, charakteru obróbki wstępnej i wynosi średnio od 6 do 23%. Tak, strawność celulozy otręby pszenne około 15%.
![]()
Ryż. 13.Mikrofibryle celulozowe podczas formowania
wtórna ściana komórkowa: 1
- gniazdo elektryczne; 2
- podwójna warstwa lipidowa
W błonnik pokarmowy celuloza stanowi około jednej trzeciej. Jego efektywny rozkład następuje w wyniku symbiotycznego oddziaływania różnych mikroorganizmów jelita grubego i ich enzymów celulolitycznych. W przewód pokarmowy celuloza pobudza czynność jelit, zwiększając ich perystaltykę, normalizuje pracę mikroflora jelitowa, absorbuje sterole, zapobiega ich wchłanianiu i sprzyja uwalnianiu cholesterolu. Celuloza mikrokrystaliczna (MCC), niewłóknista sproszkowana modyfikacja naturalnej celulozy, znalazła szerokie zastosowanie jako suplement diety. Nie tylko obniża kaloryczność pożywienia, ale jest również jego zagęszczaczem i dyspergatorem, co poprawia jakość pożywienia.
Eubakterie Gram-ujemne mają znacznie bardziej złożoną strukturę ściany komórkowej niż bakterie Gram-dodatnie. Zawiera znacznie większą liczbę różnych makrocząsteczek typ chemiczny. Peptydoglikan tworzy tylko wewnętrzną warstwę ściany komórkowej, luźno przylegającą do CPM. Dla różne rodzaje Gram-ujemne eubakterie, zawartość tego heteropolimeru jest bardzo zróżnicowana. U większości gatunków tworzy strukturę jedno- lub dwuwarstwową, charakteryzującą się bardzo rzadkimi usieciowaniami między łańcuchami heteropolimerowymi.
Niektóre bakterie ślizgowe (myksobakterie, flexibakterie) są w stanie okresowo zmieniać kształt komórek w procesie poruszania się po stałym podłożu, np. Badanie mikroskopem elektronowym wykazało jednak, że miały one ścianę komórkową typową dla eubakterii Gram-ujemnych. Najbardziej prawdopodobnym wyjaśnieniem elastyczności ściany komórkowej tych bakterii jest wyjątkowo niskie usieciowanie ich składnika peptydoglikanowego.
Gram-ujemne prokarionty mają zewnętrzna męmbrana, który obejmuje lipidy (22%), białka, polisacharydy, lipoproteiny.
Lipopolisacharydy (LPS) to heteropolimery o złożonej strukturze, które wykazują różnorodne aktywności biologiczne. Kompleks lipidowy powoduje toksyczność (reakcje zapalne, gorączka, wstrząs endotoksynowy), składnik polisacharydowy odpowiada za specyficzność antygenu O. LPS indukuje syntezę przeciwciał JgM i jest stosowany w immunologii jako adiuwant i poliklonalny aktywator limfocytów B.
Ściana komórkowa u bakterii pełni głównie funkcje kształtujące i ochronne, zapewnia sztywność, tworzy otoczkę oraz decyduje o zdolności komórek do adsorpcji fagów.
№15 Filtrowalne, inwolucyjne formy bakterii, protoplasty, sferoplasty, formy L.
protoplasty, sferoplasty, kształty L to formy bakterii bez KS
Formy L mogą powstawać w warunkach naturalnych w organizmie człowieka w wyniku długotrwałego leczenia niektórymi antybiotykami, najczęściej penicyliną.
Istnieją niestabilne i stabilne formy L bakterii. Te pierwsze są zdolne do powrotu do swojej pierwotnej postaci, gdy przyczyna, która spowodowała ich powstanie, zostanie wyeliminowana. Przywracają zdolność syntezy peptydoglikanu CS. Te ostatnie z reguły nie są zdolne do powrotu. Formy L różnych bakterii odgrywają istotną rolę w patogenezie wielu chorób zakaźnych.
Główne właściwości form L bakterii:
ciągła transformacja z grampol-s do grammatrits-e.
zmiana właściwości antygenowych
spadek zjadliwości
zdolność do długotrwałej wytrwałości
możliwość powrotu do pierwotnej postaci w przypadku niecałkowitej utraty sinety COP.
№16 Właściwości malarskie bakterii. Wyrafinowane metody barwienia. Zasada barwienia metodą Grama bakterii.
Technika barwienia metodą Grama
Na rozmaz umieszcza się bibułę filtracyjną i wlewa karbolowy roztwór fioletu goryczki na 1-2 minuty.
Usuń papier, odsącz barwnik i bez spłukiwania rozmazu wodą wlewaj płyn Lugola przez 1 minutę.
Roztwór Lugola odsącza się i preparat odbarwia w alkoholu 96 0 przez 30 sek.
Umyte wodą.
Malować 1-2 min roztwór wodny magenta.
Zasada okrążenia Przez Grama
Gram-dodatnie bakterie zatrzymują fiolet goryczki w połączeniu z jodem - fioletowy kolor bakteria;
Gram-ujemne bakterie po ekspozycji na alkohol tracą barwnik, odbarwiają się, a po potraktowaniu fuksyną ulegają zabrudzeniu kolor czerwony.
Złożone metody barwniki służą do badania struktury komórkowej i różnicowania mikroorganizmów. Zabarwione rozmazy poddaje się mikroskopii w systemie zanurzeniowym. Konsekwentnie nakładać na preparat określone barwniki różniące się składem chemicznym i kolorem, zaprawy, alkohole, kwasy itp.
właściwości malarskie bakterie (łac. tinctura, od tingo - I kolor) zdolność do wybarwiania: podatność na barwę, odporność na kwasy, alkohole i zasady, jednolitość barwy, metachromatyczność, stosunek do barwy metodą Grama.
№17 Cechy składu chemicznego ściany komórkowej bakterii kwasoodpornych. Zasada barwienia metodą Ziehla-Neelsena.
bakterie kwasoodporne. Ściana komórkowa niektórych bakterii zawiera dużą ilość lipidów i wosków, dzięki czemu są one odporne na późniejsze przebarwienia po wybarwieniu kwasami, zasadami lub etanolem (np. gatunki Mycobacterium lub Nocardia). Takie bakterie są określane jako kwasoodporne i trudne do barwienia metodą Grama (chociaż bakterie kwasoodporne są uważane za bakterie Gram-dodatnie). Do ich barwienia stosuje się metodę Ziehla-Neelsena.
Mykobakterie i nocardia charakteryzują się skomplikowaną budową ściany komórkowej. Oni, podobnie jak bakterie Gram-dodatnie, są oparte na zrębie mureinowym, ale ten ostatni jest związany z polisacharydami i lipidami. Lipidy są reprezentowane przez kwasy mikolowe, które nadają powierzchni komórki hydrofobowość. Hydrofobowość z jednej strony uodparnia komórkę na działanie różnych substancji chemicznych (takie bakterie nazywane są kwasoodpornymi), z drugiej strony hamuje wymianę komórki z otoczeniem i spowalnia jej wzrost. Dlatego środki powierzchniowo czynne dodaje się do pożywek do hodowli Mycobacterium tuberculosis. Kwasoodporność prątków jest ważną cechą diagnostyczną, do jej oznaczenia stosuje się barwienie metodą Ziehla-Neelsena.
Technika barwienia bakterii kwasoodpornych
metodą Ziehla-Neelsena
Bibułę filtracyjną umieszcza się na utrwalonym rozmazie i wlewa karbolową fuksynę Ziehla i delikatnie ogrzewa na palniku, aż pojawią się opary. Operację powtarza się 2-3 razy.
Gdy lek ostygnie, usuń bibułę filtracyjną, odsącz barwnik i przemyj lek wodą.
Lek zanurza się 2-3 razy w szklance z 5% kwasem siarkowym na 1-2 sekundy.
Preparat dokładnie przemywa się wodą i barwi zasadowym błękitem metylenowym przez 3-5 minut.
Umyte wodą i wysuszone.
Bakterie kwasoodporne nie odbarwiają się pod wpływem kwasu siarkowego i zachowują swój czerwony kolor, bakterie niekwasoodporne tracą barwnik i zabarwiają się na niebiesko błękitem metylenowym.
Nr 18 Inkluzje bakterii, ich skład i rola biologiczna. W cytoplazmie znajdują się różne inkluzje w postaci granulek glikogenu, polisacharydów, kwasu beta-hydroksymasłowego i polifosforanów (wolutyna). Są substancjami rezerwowymi dla potrzeb żywieniowych i energetycznych bakterii. Volyutin ma powinowactwo do podstawowych barwników i można go łatwo wykryć za pomocą specjalne metody zabarwienie (na przykład według Neissera) w postaci granulek metachromatycznych. Charakterystyczny układ ziarnistości wolutyny ujawnia się w prątku błonicy w postaci intensywnie wybarwionych biegunów komórki. (według Neissera ma kolor ciemnoniebieski)
№19 Zarodniki bakterii, ich struktura Niektóre bakterie pod koniec okresu aktywnego wzrostu są w stanie tworzyć zarodniki. Poprzedza to zubożenie środowiska w składniki pokarmowe, zmiana jego pH oraz nagromadzenie toksycznych produktów przemiany materii. Z reguły jedna komórka bakteryjna tworzy jeden zarodnik - lokalizacja zarodników jest różna (centralna, końcowa, podkońcowa)
Jeśli rozmiar zarodników nie przekracza poprzecznego rozmiaru bakterii w kształcie pałeczki, to ta ostatnia nazywana jest Bacillus (czynnik sprawczy wąglik). Gdy średnica zarodników jest większa, bakterie mają kształt wrzeciona i nazywane są Clostridium (czynniki sprawcze infekcji beztlenowej). Clostridia tężca mają okrągłe zarodniki i przypominają pałeczki. Clostridia botulinum charakteryzują się dużymi owalnymi zarodnikami, nadającymi im wygląd rakiety tenisowej.
Zgodnie ze składem chemicznym różnica między zarodnikami a komórkami wegetatywnymi polega tylko na ilościowej zawartości związków chemicznych. Zarodniki zawierają mniej wody i więcej lipidów.
Powstawanie zarodników wiąże się z zagęszczaniem i izolacją pewnego obszaru cytoplazmy komórki wegetatywnej, po czym następuje utworzenie okrągłego lub owalnego ciała wewnątrz bakterii, pokrytego gęstą wielowarstwową błoną nasyconą duża ilość lipidów, wapnia i kwasu dipikolinowego (ryc. 12).
W organizmie ludzi i zwierząt zarodniki kiełkują w komórki wegetatywne. Proces kiełkowania zarodników obejmuje trzy etapy: aktywację, etap początkowy i etapy wzrostu. Czynnikami aktywującymi zaburzającymi stan uśpienia są podwyższona temperatura, kwaśny odczyn środowiska, uszkodzenie mechaniczne i inne.Zarodnik zaczyna wchłaniać wodę, jest uwalniany z dipikolanu wapnia i niszczy wiele własnych składników strukturalnych za pomocą enzymów hydrolitycznych. Po zniszczeniu warstw zewnętrznych rozpoczyna się okres formowania się komórki wegetatywnej od aktywacji biosyntezy, kończący się podziałem komórki.
Metoda barwienia zarodników według Ozheshko
Zarodniki mocno trzymają fuksynę karbolową i barwią się na czerwono, cytoplazma bakterii odbarwia się 5% kwasem siarkowym i po barwieniu błękitem metylenowym staje się niebieska.
№20 Kapsułka i mikrokapsułka bakterii Kapsułka to śluzowa warstwa ściany komórkowej bakterii, składająca się z polisacharydów (pneumokoki) lub polipeptydów (bałteria wąglika). Mikrokapsułki (o grubości poniżej 0,2 µm) mogą być tworzone przez większość bakterii, dobrze zdefiniowaną makrokapsułkę (o grubości powyżej 0,2 µm) tworzą pneumokoki, Klebsiella, wąglik i niektóre inne. W bakteriach chorobotwórczych kapsułka tworzy się w makroorganizmie, na sztucznych pożywkach jest zwykle tracona (z wyjątkiem Klebsiella).
U ludzi i zwierząt kapsułka chroni bakterie chorobotwórcze od bakteriofaga, fagocytozy i humoralnych czynników odpornościowych, określa specyficzność antygenową mikroorganizmów.
Kapsułki o żelowej konsystencji nie zatrzymują dobrze barwnika, a do ich wykrywania najczęściej stosuje się metody kontrastu ujemnego.
Metoda wykrywania kapsułek Burri-Gins
Bakterie są zabarwione na czerwono, niezabarwione kapsułki kontrastują z ciemnym tłem leku.
№21 Wici bakteryjne Wici działają jak narząd ruchu, który pozwala bakteriom poruszać się z prędkością 20-60 mikronów/sek. Bakterie mogą mieć jedną (monotrichous) lub kilka wici, rozmieszczonych na całej powierzchni ciała (peritrichous) lub zebranych w pęczki (lofotrichous).
Peritrichous lokalizacja wici jest charakterystyczna dla enterobakterii, patogenów infekcji beztlenowych, tężca, zatrucia jadem kiełbasianym; Vibrio cholerae to monotrich, a Pseudomonas to lophotrich. Niektóre gatunki spirilli mają amfitryczne ułożenie wici. Grubość wici wynosi średnio 10-30 nm, a długość sięga 10-20 mikronów.
Podstawą wici jest długie spiralne włókno (włókno), które na powierzchni ściany komórkowej przechodzi w pogrubioną zakrzywioną strukturę - haczyk i jest przyczepione do ziarnistości podstawnej osadzonej w ścianie komórkowej i CPM (ryc. 10). .
Granulki podstawne mają średnicę około 40 nm i składają się z kilku pierścieni (jedna para u bakterii Gram-dodatnich, cztery u Gram-ujemnych prokariotów). Usunięcie warstwy peptydoglikanu ze ściany komórkowej prowadzi do utraty zdolności bakterii do poruszania się, chociaż wici pozostają nienaruszone.
Wici składają się prawie wyłącznie z białka flageliny, z pewną zawartością węglowodanów i RNA.
Pod mikroskopem wici można zobaczyć dopiero po specjalnych metodach trawienia i impregnacji solami srebra i rtęci, a następnie barwienia błękitem metylenowym (metoda Lefflera). Należy pamiętać, że wici są bardzo wrażliwe na różne wpływy mechaniczne. Obecność wici można pośrednio ocenić na podstawie kierunkowego charakteru ruchu „wiszącej” i „zmiażdżonej” kropli w mikroskopach ciemnego pola i kontrastu fazowego lub w mikroskopie jasnego pola z opuszczonym kondensorem i częściowo przysłoną mikroskopu pokryty.
Barwienie wici metodą Lefflera
Pod mikroskopem ukończony produkt wici są widoczne jako cienkie nitkowate struktury.
#22 Pili Powierzchnia enterobakterii i kilku innych mikroorganizmów jest pokryta duża liczba(od 10 do kilku tysięcy) kosmki - nitkowate formacje o charakterze białkowym. Podobnie jak wici zbudowane są z jednego rodzaju białka - pilinu, którego podjednostki zorganizowane są w formie pustej w środku nici i wywodzą się z CPM. Są krótsze i cieńsze niż wici, ich szerokość wynosi 10–12 nm, a długość do 12 μm.
Kosmki są wielofunkcyjne: zapewniają zakaźny transfer genów (koniugację), są receptorami fagów, narządem, w którym bakterie przyczepiają się do substratu odżywczego (adhezja) i uczestniczą w transporcie metabolitów.
Paciorkowce mają zewnętrzną warstwę włosków białkowych (fimbria), które nazywane są białkiem M (białko M). Ta wiewiórka gra ważna rola w procesach interakcji bakterii z makroorganizmem.
№23 promieniowce
Reprezentują osobliwą grupę bakterii, które wyglądają jak małe lub długie, rozgałęzione włókna bez przegrody. Nagromadzenie strzępek nazywa się grzybnią. Podobieństwo do grzybów jest czysto zewnętrzne, ponieważ promieniowce mają typ komórek prokariotycznych ze ścianą komórkową, która nie zawiera chityny i celulozy. Promieniowce są Gram-dodatnie, wiele form jest kwasoodpornych, niektóre promieniowce mają otoczkę wokół włókien.
Grzybnia podłoża powstaje w wyniku wrastania grzybni do pożywki i powietrza, rosnących na powierzchni pożywki (ryc. 19). W dotkniętych tkankach (postać tkankowa) promieniowce mogą tworzyć granulki druzów, z gęsto splecionych nici w postaci promieni rozciągających się od środka i kończących się zgrubieniami w kształcie kolb.
Promieniowce rozmnażają się bezpłciowo, tworząc konidia lub sporofory ze sporangiami na końcach grzybni powietrznej. Nosiciele zarodników mogą być proste, faliste, spiralne. Zarodniki - owalne, okrągłe, cylindryczne, o gładkiej powierzchni lub kolcach, czasem ruchome dzięki wici (zoospor). Zarodniki służą do rozmnażania promieniowców, nie są odporne na ciepło, ale mogą wytrzymać suszenie. Ponadto możliwe jest pączkowanie i fragmentacja grzybni na formy w kształcie pręta lub kokosa.
Promieniowce są szeroko rozpowszechnione w przyrodzie, żyją w wodzie, glebie bogatej w próchnicę. Uczestniczą w obiegu substancji w przyrodzie. Oddzielne typy promieniowce są wykorzystywane jako producenci antybiotyków, witamin, lipidów, proteaz, aminokwasów, steroidów.
Actinomycetes należą do rzędu Actinomycetales, który obejmuje rodziny: Actinomycetaceae, Nocardiaceae, Streptomycetaceae, Mycobacteriaceae.
Gatunki patogenne dla człowieka występują wśród przedstawicieli rodzin Actinomycetaceae i Nocardiaceae. Te pierwsze wyglądają jak długie lub krótkie rozgałęzione patyki, które nie tworzą grzybni powietrznej. Są czynnikami wywołującymi promienicę u ludzi i tworzą druzy w dotkniętych tkankach.
Przedstawiciele rodziny Nocardiaceae przypominają mykobakterie, mają komórki nitkowate i tworzą grzybnię powietrzną i substratową na pożywkach. Strzępki są podzielone na komórki kokosowe i pręcikowate. Patogenna nokardia powoduje nokardiozę.
Metody badawcze. barwiono metodą Grama i Ziehla-Neelsena. Druza jest usuwana z materiału patologicznego za pomocą pętli, umieszczana w kropli wody na szkiełku podstawowym, lekko dociskana szkiełkiem nakrywkowym, następnie pod szkiełkiem wprowadzana jest kropla alkalicznego roztworu błękitu metylenowego i pod mikroskopem kontrast fazowy może być użyte.
№24 Krętki
spiralnie skręcone bakterie o aktywnej ruchliwości. Wymiary krętków różnią się grubością od 0,1-0,3 mikrona, długością od 7-500 mikronów. Różnorodne ruchy - od spiralnych do zgięciowych. Badanie mikroskopem elektronowym pozwoliło wyróżnić u krętków cylinder protoplazmatyczny (ciało komórki), nitkę osiową (nośną) oraz trójwarstwową otoczkę zewnętrzną. Włókno osiowe znajduje się w przestrzeni peryplazmatycznej między zewnętrzną powłoką a cylindrem protoplazmatycznym i składa się z pojedynczych włókienek (endofagelli), których liczba jest różna u różnych gatunków: w treponema i leptospira - 3-4; w borelii - do 30. Każdy z włókienek (endoflagella) jest umocowany w obszarze dysków mocujących na końcach cylindra protoplazmatycznego i rozciąga się na jego przeciwległy koniec, owijając się wokół niego i kończąc swobodnie. Skład chemiczny włókienek jest podobny do wici (ryc. 20).
Cylinder protoplazmatyczny zawiera: nukleoid, rybosomy, mezosomy, inkluzje. Zewnętrzna powłoka (ściana komórkowa) zawiera cienką warstwę peptydoglikanu, jest elastyczna i nie ma sztywności. Bakterie te nie tworzą przetrwalników, torebek i eksflagellatów, są Gram-ujemne, w rozmazie rozmieszczone są losowo.
Krętki należą do rzędu Spirochaetales, rodziny Spirochaetaceae, która obejmuje trzy rodzaje:
Borrelia - ma 3-10 nierówno ukośnych loków, końce są spiczaste, długości 10-30 mikronów. Ruch jest gwałtowny, według Romanowskiego-Giemsy, są pomalowane na niebiesko fioletowy(przedstawiciel Borreliarecurrentis – powoduje epidemię gorączki nawrotowej; Borreliaburgdorferi – powoduje boreliozę).
Treponema - ma 8-14 mocno skręconych loków o równej amplitudzie, długości 5-15 mikronów. Ruch jest płynny, powolny z obrotem wokół osi podłużnej, według Romanowskiego-Giemsy, są pomalowane na blado kolor różowy(przedstawiciel Treponemapallidum - czynnik sprawczy kiły).
Leptospira - ma do dwóch tuzinów małych częstych loków zakończonych haczykiem z pogrubieniem przypominającym guzik, o długości 5-15 mikronów. Ruch jest bardzo aktywny, translacyjny ruch do przodu, zginanie i obrót wokół osi. Według Romanovsky'ego-Giemsy wybarwiają się słabo na różowo-liliowy kolor (przedstawiciel Leptospirainterrogans jest czynnikiem sprawczym leptospirozy).
Metody badawcze. Krętki w stanie żywym bada się pod mikroskopem z kontrastem fazowym i mikroskopem ciemnego pola, obserwując aktywny charakterystyczny ruch krętki, cechy ich formy.
Preparaty przygotowywane są wg Burri (na ciemnym tle preparatu widoczne są jasno karbowane włókna krętków), barwione wg Romanowskiego-Giemsy, wg metody Morozowa.
#25 Rickettsia
klasa " alfaproteobakterie"
Zamówienie Rickettsiales
Rodzina Rickettsiaceae
Rodzaj Rickettsia
Rodzina Ehrlichiaceae
Rickettsiae mają zróżnicowany kształt i dzielą się na następujące typy:
kokosowy jednoziarnisty (do 0,5 mikrona);
dwuziarnisty w kształcie pręta (1-1,5 mikrona);
bakteryjne trzy-cztery-ziarniste (3-4 mikrony);
nitkowaty wieloziarnisty (10-40 mikronów).
Ziarna (nukleoproteiny) są wykrywane przez barwienie według Romanovsky'ego-Giemsy. Wszystkie formy są wzajemne. Strukturalnie mają wszystkie składniki komórki bakteryjnej: ścianę komórkową, otoczkę lipidową, cytoplazmę, nukleoid, rybosomy, pilusy. Rickettsia zawiera zarówno DNA, jak i RNA, mają wysoka zawartość fosfolipidy, niska zawartość węglowodanów.
W większości przypadków (z wyjątkiem gatunku Rochalimaeaguintana) riketsje nie rosną na sztucznych pożywkach. Cykl życiowy riketsji zależy od aktywności życiowej komórki gospodarza i składa się z dwóch etapów: wegetatywnego i spoczynkowego (organizmy elementarne). Riketsje znajdujące się w fazie wegetatywnej (ryc. 23) aktywnie rozmnażają się przez rozszczepienie binarne i mają aktywną ruchliwość, najwyraźniej dzięki strukturom wici. Rickettsia fazy spoczynkowej (ciała elementarne) są kuliste i nieaktywne.
Metody badawcze. Riketsje są dobrze wybarwione według Romanowskiego-Giemsy w kolorze liliowym, według Morozowa (metodą srebrzenia) w kolorze czarnym. Aby odróżnić riketsję, metoda barwienia zaproponowana przez P.F. Zdrodowski:
Riketsje wybarwiają się na rubinowo i są łatwo wykrywalne na tle niebieskiej cytoplazmy i niebieskiego jądra komórkowego.
№26 Chlamydia
klasa Chlamydia
Zamówienie Chlamydia
rodzina Chlamydiowate
Rodzaj: Chlamydia
1). Ciała elementarne to małe (0,2-0,5 μm) gęste elektronowo sferyczne struktury, pozbawione aktywności metabolitów, posiadające zwarty nukleoid i sztywną ścianę komórkową, które są filtrowane przez filtry bakteryjne. Stanowią infekcyjny początek chlamydii i zapewniają jej przetrwanie w środowisku pozakomórkowym oraz infekcję nowych komórek.
2). Ciała siatkowate są większe (0,8-1,5 mikrona), kuliste formacje o strukturze siatki z cienką ścianą komórkową i włóknistym nukleoidem. Wyrastają z elementarnych ciałek wewnątrz komórek, są pozbawione zakaźności i dzieląc się zapewniają namnażanie się chlamydii. Stąd inna, historycznie pierwsza nazwa ciał siatkowatych - "ciało początkowe". Ciała siatkowate są wegetatywną formą chlamydii.
3). Ciała pośrednie są etapem pośrednim między ciałami elementarnymi i siatkowatymi.
Cykl życiowy chlamydii rozpoczyna się od tego, że ciałka elementarne są fagocytowane przez komórkę gospodarza, a następnie w ciągu kilku godzin reorganizują się, powiększają i przekształcają w formy siatkowate, które rozmnażają się przez podział poprzeczny. Cykl życiowy kończy się, gdy powstające formy pośrednie są zagęszczane, zmniejszane i przekształcane w ciała elementarne. Rozmnażając się wewnątrz wakuoli cytoplazmatycznych, chlamydie tworzą mikrokolonie (inkluzje) otoczone błoną. Wszystkie trzy etapy rozwoju chlamydii znajdują się w składzie mikrokolonii. Po pęknięciu ściany wakuoli (pęcherzyków) i błony komórki gospodarza nowo utworzone chlamydie są uwalniane, a ciałka elementarne, infekując inne komórki, powtarzają cykl rozwojowy. W optymalnych warunkach wzrostu w komórkach eukariotycznych koło życia chlamydii wynosi 17-40 godzin (ryc. 24).
Osobliwość chlamydii przejawia się również w strukturze ich ściany komórkowej. Jest pozbawiona peptydoglikanu i jest błoną dwuwarstwową, o której sztywności decydują peptydy usieciowane mostkami dwusiarczkowymi. Poza tym chlamydie przypominają bakterie Gram-ujemne, ponieważ zawierają glikolipidy podobne do lipopolisacharydów.
Rząd Chlamydiales obejmuje jedną rodzinę, Chlamydiaceae, z jednym rodzajem, Chlamydia. Gatunkami chorobotwórczymi dla ludzi są C.trachomatis, C.psittaci, C.pneumoniae. Chlamydia powoduje oczy, drogi oddechowe i układy moczowo-płciowe i zjednoczyć się pod Nazwa zwyczajowa„chlamydia”.
Metody badawcze. Do mikroskopowego wykrywania ciał inkluzyjnych (mikrokolonii) chlamydii w zakażonych komórkach (tkankach) stosuje się różne metody barwienia: Romanovsky-Giemsa, Macchiavello i inne. Po zabarwieniu według Romanowskiego-Giemsy nabierają koloru niebieskiego lub fioletowego. Ponadto chlamydie są wyraźnie widoczne w stanie niebarwionym podczas mikroskopii wilgotnych preparatów pod szkłem przy użyciu układu optycznego z kontrastem fazowym. W Ostatnio najczęściej stosowana bezpośrednia reakcja immunofluorescencyjna, barwienie oranżem akrydynowym.
№27 Mykoplazmy klasa Mollicutes
Zamówienie Mycoplasmatales
Rodzina mykoplazmatowate
rodzaju Mycoplasma
rodzaj Ureaplasma
Pięć gatunków jest chorobotwórczych dla ludzi: M . zapalenie płuc , M . człowiek , M . narządy płciowe , M . nieznajomy I u . urealityczny .
Mykoplazmy- najmniejsze prokarionty (125-150 nm) zdolne do samodzielnego rozmnażania się. Uważa się, że mykoplazmy są najbliższymi potomkami pierwotnych komórek prokariotycznych. Genom mykoplazmy jest minimalny jak na komórkę, jest pięć razy mniejszy niż genom coli i wynosi 0,45 MD. Główną cechą mykoplazm jest brak ściany komórkowej. Otoczone są otoczką przypominającą kapsułkę, pod którą znajduje się jedynie cienka trójwarstwowa membrana o grubości 7,5-10 nm, zawierająca znaczną ilość cholesterolu. W rezultacie mykoplazmy są izolowane w specjalnym dziale Tenericutes, klasa Mollicutes („delikatna skóra”), zamówienie Mycoplasmatales.
Ze względu na brak ściany komórkowej mykoplazmy (ryc. 21) są wrażliwe osmotycznie i mają różnorodne kształty:
a) małe kuliste lub jajowate komórki o wielkości 0,2 µm (ciałka elementarne), które są filtrowane przez filtry bakteryjne;
b) większe kuliste, o wielkości do 1,5 mikrona;
c) nitkowate, rozgałęzione komórki o wielkości do 150 mikronów.
Mykoplazmy nie tworzą zarodników, wici, niektóre gatunki mają ruchliwość ślizgową.
Rozmnażają się przez binarne rozszczepienie kulistych i nitkowatych komórek, pączkowanie i uwalnianie wielu elementarnych ciał utworzonych we włóknach.
Jeśli chodzi o energię, mykoplazmy uzyskują ją w zwykły sposób dla fakultatywnych beztlenowców, poprzez fermentację węglowodanów lub aminokwasów. Ze względu na mały genom mykoplazmy mają one ograniczone zdolności biosyntetyczne i muszą być hodowane na pożywkach wzbogaconych w lipidy, białka, prekursory kwasów nukleinowych. Rosną powoli, kolonie z gęstym środkiem wrastają w podłoże, przypominając „jajko sadzone” (ciemny środek i jaśniejszy ażurowy obwód). Wielkość kolonii jest niewielka, nie przekracza 600 mikronów.
W patologii człowieka największą rolę odgrywa kilku przedstawicieli rodzaju Mycoplasma: M.pneumoniae, M.hominis, M.anthritidis oraz jedyny gatunek z rodzaju Ureaplasma – U.urealyticum (nazwany tak ze względu na aktywność ureazy). Patogenne mykoplazmy powodują choroby (mykoplazmozy) układu oddechowego, moczowo-płciowego i stawów o różnych objawach klinicznych. Podczas leczenia tych chorób należy pamiętać, że mykoplazmy nie są wrażliwe na antybiotyki beta-laktamowe i inne leki hamujące syntezę ściany komórkowej (ze względu na jej brak w patogenie).
Metody badawcze. W mikroskopie świetlnym znajdują się tylko największe formy mykoplazmy. W stanie żywym są badane w mikroskopie ciemnego pola i kontrastu fazowego, składniki ultrastrukturalne są wykrywane za pomocą mikroskopii elektronowej.
№28 Grzyby
Klasy (7): · podstawczaki(pieczarki kapeluszowe). · Zygomycetes (rodzaj Mukor - mukormykoza ludzi i zwierząt) Ascomycetes (torby, rodzaje kropidlak , Penicillium , grzyby drożdżowe) Deuteromycetes - grzyby niedoskonałe, nie rozmnażają się płciowo ( Candida )
Grzyby to duża i pomyślnie rozwijająca się grupa organizmów, obejmująca około 80 000 zidentyfikowanych gatunków. Ich rozmiary wahają się od jednokomórkowych drożdży po duże perkozy, purchawki i rogi. Grzyby zajmują różnorodne siedliska – zarówno w wodzie, jak i na lądzie. Ponadto są one ważne w związku z rolą, jaką pełnią w biosferze, oraz w związku z tym, że są wykorzystywane przez człowieka w medycynie i gospodarce.
Metody badawcze. Do badania mikroskopowego przygotowuje się zarówno preparaty natywne (niebarwione), jak i barwione.
Badanie preparatów niebarwionych
Aby wyraźniej rozróżnić elementy grzyba, preparat jest klarowny, w tym celu materiał patologiczny (skorupy, kawałki paznokcia, włosy, zeskrobiny z błon śluzowych, zawartość ognisk ziarniniakowych) umieszcza się na szkiełko zegarowe lub szalkę Petriego, do której wlewa się 10-15% roztwór żrącego sodu lub potasu i umieszcza w termostacie w temperaturze 37 0 C na 20-30 minut. Następnie materiał jest usuwany i umieszczany w kropli 50% roztworu glicerolu na szkiełku podstawowym i przykrywany szkiełkiem nakrywkowym, mikroskopowo w mikroskopie fazowo-kontrastowym lub świetlnym. Można zastosować inną metodę: kroplę gliceryny z dodatkiem 10% żrącego potasu nanosi się na materiał patologiczny i bada po 4-5 minutach, przykrywa szkiełkiem nakrywkowym.
Ropę z ropni, zawartość wrzodów, plwocinę rozcieńcza się solą fizjologiczną lub wodą z alkoholem (1:1) lub 50% wodnym roztworem glicerolu, przygotowuje się preparat „pokruszonej kropli” i bada w powiększeniu x200, x400 z kontrastem fazowym.
Badanie preparatów barwionych
Z ropy, krwi, płynu mózgowo-rdzeniowego, osadu popłuczyn oskrzelowych i moczu przygotowuje się cienkie rozmazy, które utrwala się w mieszaninie Nikiforowa, Carnoya, alkoholu i formolu, suszy i barwi:
Kolorowanie laktofuksyna zawierający kwaśną fuksynę - 0,1 g, kwas mlekowy - 100 ml. Barwione przez 3-5 minut. Tło leku jest różowe, grzybnia opalizuje na niebiesko. Grzyby dobrze plamią mukormykozą i aspergilozą.
№29 Drożdże i drożdżopodobne Komórki drożdży mają okrągły, kulisty lub wydłużony kształt, o wielkości 8-10 mikronów, z dwuobwodową membraną. W cytoplazmie odnotowuje się wtrącenia w postaci granulek glikogenu, wolutyny i lipidów. Rozmnażanie odbywa się przez pączkowanie i askospory. Drożdże drożdżopodobne są podobne do prawdziwych drożdży, różnica polega na braku askospor i zdolności do tworzenia pseudomycelium. Wraz z tworzeniem grzybni pseudomycelium komórki wydłużają się i dotykają wąską podstawą. Powodują kandydozę, która rozwija się u chorych z gwałtownym spadkiem odporności organizmu i długotrwałym stosowaniem antybiotyków. Metody badania drożdży
Współczesny okres badań nad różnorodnością biologiczną charakteryzuje się intensywnym rozwojem systematyki filogenetycznej, która ma na celu odtworzenie określonych ścieżek historycznego rozwoju organizmów. W mikrobiologii systematyka filogenetyczna otrzymała potężny impuls do rozwoju dopiero pod koniec XX wieku. w związku z badaniami porównawczymi konserwatywnych sekwencji nukleotydowych w rRNA. U drożdży taksonomia ta opiera się głównie na badaniu dwóch regionów rDNA o długości około 600 par nukleotydów: domeny D1/D2 na końcu 5' genu kodującego 26S rRNA oraz wewnętrznego transkrybowanego regionu rozdzielającego (ITS) , który obejmuje gen rRNA 5.8S. Uważa się, że ze względu na konserwatyzm tych regionów różnice między nimi są wprost proporcjonalne do odległości filogenetycznej, stopnia pokrewieństwa ewolucyjnego. Sekwencjonowanie niekleotydowych sekwencji rDNA okazało się potężne narzędzie do konstruowania klasyfikacji filogenetycznej drożdży i określania ich miejsca w ogólnym systemie grzybów.
Dotychczas sekwencje nukleotydowe rRNA zostały rozszyfrowane i umieszczone w komputerowych bankach danych dostępnych w Internecie u przedstawicieli wszystkich znane gatunki drożdże. Pozwala to na budowanie drzew filogenetycznych odzwierciedlających ewolucję ich genów rybosomalnych. Okazało się, że grupowanie drożdży na podstawie podobieństwa sekwencji nukleotydowych rRNA w wielu przypadkach nie pokrywa się z grupowaniem według cech fenotypowych. Wiele tradycyjnych cech stosowanych w klasyfikacji drożdży, takich jak cechy rozmnażania wegetatywnego, kształt askospor, fermentowalność i przyswajanie cukru, uznano za niewiarygodne i nieodpowiednie do określania zależności filogenetycznych. Sekwencjonowanie rRNA (rDNA) jest obecnie uważane za niezbędne przy opisywaniu nowych gatunków drożdży.
Szczególnie silny wpływ na badania drożdży, a także większości innych grup mikroorganizmów, miał gwałtowny rozwój pod koniec XX wieku. Biologia molekularna. We współczesnej taksonomii drożdży szeroko stosowane są metody systematyki genów oparte na bezpośrednim porównaniu genomów i sekwencjonowaniu sekwencji nukleotydowych. Zastosowanie ujednoliconych metod biologii molekularnej pozwoliło jeszcze bardziej zbliżyć podejście do taksonomii drożdży i grzybów nitkowatych, ustalić powiązania między anamorfami drożdży a teleomorfami nitkowatymi oraz opracować nowe kryteria tworzenia jednolitego systemu filogenetycznego dla całego królestwa Mycota . W tym samym czasie nowa wiedza rodziła nową problemy naukowe w szczególności problem korelacji między najnowszymi metodami molekularnymi a tradycyjnymi metodami opartymi na morfologicznym i fizjologicznym podejściu do badania drożdży. Genom Saccharomyces cerevisiae został prawie całkowicie rozszyfrowany, co otwiera przed genomiką drożdży ogromne perspektywy i nowe horyzonty ich biotechnologicznego wykorzystania. Tak więc nauka o drożdżach, która przebyła ponad półtora wieku, nadal szybko się rozwija w XXI wieku.
Do badania mikroskopowego przygotowuje się zarówno preparaty natywne (niebarwione), jak i barwione. Aby zbadać grzyby w tkankach, przeprowadza się badanie patohistologiczne.
komórkowa grzybnia zarodników drożdży
30. Morfologia i metody badań grzybów strzępkowych. Istnieją 2 rodzaje wzrostu grzybów: wzrost strzępek (Hyphomycetes) i wzrost drożdży (blastomycetes). Zwykle ciało wegetatywne grzybów nitkowatych składa się z włókien o grubości około 5 µm, silnie rozgałęzionych i zwanych strzępkami. Strzępki albo nie mają przegród poprzecznych (u grzybów niższych), albo są oddzielone przegrodami (przegrody) na komórki (u grzybów niższych) wyższe grzyby). Ściana komórkowa może mieć różną grubość, obejście jest często wyraźnie widoczne; wśród inkluzji w cytoplazmie najbardziej charakterystyczne są ziarna wolutyny, glikogenu, pigmentu melaniny. Dojrzałe stare komórki grzybów są bogate w lipidy. Jądro zawiera jąderko i sieć chromatyny; komórki mogą być wielojądrowe. Zbiór strzępek tworzy grzybnię (grzybnię). Grzybnią może być podłoże, powstałe w wyniku wrastania strzępek w pożywkę oraz powietrze, narastające na powierzchni pożywki. Grzybnia reprezentuje rozgałęzione rurki, rozgałęzienia są przeprowadzane przez boczne wyrostki strzępek. Włókna grzybni są czasami ułożone w równoległe rzędy, ściśle przylegające do siebie, przypominające „knot”, stąd nazwa „koremia” (u dermatofitów).
31. Podstawowe zasady klasyfikacji i morfologii pierwotniaków. Metody ich badania i znaczenie medyczne.
Pierwotniaki to jednokomórkowe eukarionty, podobne w strukturze do komórek złożonych zwierząt. Kształt może być gruszkowaty (Trichomonas, Giardia), jajowaty (Balantidia), wrzecionowaty (Trypanosoma, Leishmania), może przybierać najdziwniejsze konfiguracje (ameba)
Większość pierwotniaków jest ruchoma, a ruch odbywa się za pomocą pseudopodiów (ameba, plasmodium malarii), wici (giardia, leishmania), rzęsek (balantidia).
pseudopodia- chwilowe wypukłości cytoplazmy, uwalniające się, które pierwotniaki cały czas zmieniają kształt ciała.
Najprostsze należą do królestwa Protozoa (protos - pierwszy, zoa - zwierzęta). Znaczenie medyczne mają:
Gromada Sarcomastigophora, podtyp Sarcodina (Sarcodidae). Ich ciało pozbawione jest błonki, poruszają się za pomocą pseudopodiów. Ta klasa obejmuje Różne rodzaje ameba, w tym ameba czerwonkowa (Entamoeba histolytica).
Metody badawcze. Do badania pierwotniaków przygotowywane są preparaty tymczasowe i trwałe (zabarwione). Preparaty tymczasowe przygotowuje się metodą „kropli kruszonej” lub „kropli wiszącej” z dodatkiem ciepłej Sól fizjologiczna lub żywotne barwniki przyżyciowe. Z preparatów krwi przygotowuje się „gęstą kroplę”. Aby to zrobić, palec traktowany eterem obraca się z nakłuciem w dół, a szklane szkiełko doprowadza się do wystających kropli, na które pobiera się 2-3 krople krwi, a następnie krew rozprowadza się igłą lub rogiem kolejne szkiełko do uzyskania owalu około 1 cm, aby przyspieszyć wysychanie leku, można je umieścić w termostacie w temperaturze 35-37 0 C.
Do wykrywania cyst stosuje się silny płyn Lugola, który zabarwia struktury cyst na ciemnobrązowy kolor.
Barwiono hematoksyliną żelaza metodą Heidenhaina
Rozmazy po utrwaleniu umieszcza się w 2,5% roztworze ałunu żelazowego na 1 godzinę.
Po trzykrotnym przepłukaniu wodą barwić barwnikiem (0,5 g hematoksyliny, 10 ml alkoholu 96 0, a po rozpuszczeniu dodać 90 ml wody destylowanej) przez 5-10 minut.
Umyte wodą i wysuszone.
Zabarwienie jest niezbędne w przypadkach, gdy konieczne jest ujawnienie najdrobniejszych szczegółów struktury jądra i cytoplazmy pierwotniaków.
Ściany komórkowe roślin mają niezwykłą wytrzymałość, a w procesie wzrostu rośliny zmieniają swoją strukturę i skład. Głównymi składnikami ścian komórkowych roślin są polisacharydy, wśród których dominuje celuloza, która w dużej mierze determinuje architekturę ściany.
Celuloza. Ten homopolisacharyd jest najpowszechniejszym węglowodanem na Ziemi (rośliny wytwarzają do 1011 ton celulozy rocznie). Monomery celulozy to reszty glukozy połączone w długie łańcuchy (do 10 000 reszt glukozy w każdym) za pomocą wiązań b (1 → 4) -glikozydowych (ryc. 5.3). W takiej cząsteczce nie ma pełnej swobody rotacji wokół wiązań 1C-O- i O-4C, a polimer uzyskuje konformację sprzyjającą tworzeniu międzyłańcuchowych wiązań wodorowych, gdy łańcuchy są ułożone antyrównolegle. W rezultacie cząsteczki celulozy łączą się w mikrofibryle około 10 do 25 nm grubości. Mikrofibryle przeplatają się i formują cienkie nici, które z kolei mogą być owinięte jedno wokół drugiego, jak pasma liny, formując się makrofibryle. Każda makrofibryla ma grubość około 0,5 µm i może osiągnąć długość 6-8 µm. Wytrzymałość makrofibryli jest porównywalna z wytrzymałością równej grubości drutu stalowego. Oprócz, oddzielne sekcje mikrofibryle mają uporządkowaną strukturę i nadają ścianie komórkowej właściwości krystaliczne. Można więc zauważyć złożoność i duże uporządkowanie celulozy w składzie ścian komórkowych, co nie jest przypadkiem: polimer ten pełni w roślinie funkcje ochronne i wspomagające.
W tej postaci polisacharydy są niedostępne dla działania własnych enzymów, a celuloza nie może być wykorzystana przez roślinę jako substancja rezerwowa. Tylko kilka organizmów (niektóre bakterie, grzyby, pierwotniaki i rzadkie zwierzęta) posiada układy enzymatyczne zdolne do rozkładania celulozy.
Mikro- i makrofibryle celulozy w ścianie komórkowej roślin są zanurzone matryca, który również składa się głównie z polisacharydów i zmienia swoją strukturę podczas wzrostu roślin. NA wczesne stadia składa się z matrycy rozwojowej substancje pektynowe, a następnie pojawiają się w nim ksylany i różne obojętne polisacharydy („hemiceluloza”). Substancje pektynowe to polimery kwasu a-galakturonowego, w których część atomów wodoru zastąpiono grupami metylowymi (-CH 3) (ryc. 5.3). Ksylany to polimery ksylozy (Rysunek 5.3).
W późniejszych stadiach rozwoju, gdy następuje lignizacja ścian komórkowych, lignina- zawierająca chemoodporny polimer duża liczba pierścienie aromatyczne. Ponadto w składzie ścian komórkowych roślin znajdują się niewielkie ilości glikoprotein, nierozpuszczalnych polimerów lipidowych. inna struktura i woski.
Ściany komórkowe niektórych roślin zawierają rzadkie polisacharydy o niezwykłej budowie. Na przykład w ścianach i przestrzeniach międzykomórkowych
Substancja z czerwonych alg morskich zawiera złożony agar heteropolisacharydowy, będący mieszaniną siarczanowanych polisacharydów - agarozy i agaropektyny. Agaroza zbudowana jest z naprzemiennych reszt D-galaktozy i 3,6-anhydro-L-laktozy połączonych naprzemiennie wiązaniami b(1→4)- i a(1→3). Agaropektyna ma więcej złożona struktura: Zawiera D-galaktozę, 3,6-anhydrogalaktozę, kwasy uronowe i siarczany. Agar jest najczęściej stosowanym zagęszczaczem do pożywek stałych, niezbędnym w mikrobiologii, a także w Przemysł spożywczy do produktów żelujących. Należy zauważyć, że zdecydowana większość mikroorganizmów nie jest w stanie rozłożyć agaru i jest to jedna z jego głównych zalet w porównaniu z innym kompaktorem pożywek - żelatyną. Znaleziska agarozy szerokie zastosowanie w badaniach biochemicznych: ona środowisko wodne tworzy żel z dużymi porami, których wielkość zależy od jego stężenia. Żele agarozowe służą do frakcjonowania białek i kwasów nukleinowych, a także do immobilizacji komórek.
- 20,44 KbŚciana komórkowa, budowa, skład chemiczny. Zmiany w ścianie komórkowej.
Obecność mocnej skorupy Charakterystyka komórka roślinna, która odróżnia ją od komórki zwierzęcej. Otoczka nadaje komórce określony kształt i wytrzymałość oraz chroni żywą zawartość - protoplast, a przede wszystkim plazmalemę, mocno dociśniętą do skorupy od wewnątrz. Uprawiane na specjalnych pożywkach komórki roślin wyższych, w których błona jest usuwana metodą enzymatyczną, przybierają zawsze kulisty kształt. Bez powłoki istnienie komórki roślinnej w normalnych warunkach jest niemożliwe, ponieważ charakterystyczne dla niej ciśnienie turgoru, zrównoważone przeciwciśnieniem powłoki, nieuchronnie doprowadziłoby do pęknięcia plazmalemmy i zniszczenia protoplastu. Całość ścian komórkowych w składzie ciała rośliny lądowej, która wznosi się ponad powierzchnię gleby i nie ma wewnętrznego szkieletu, jest rodzajem ramy nośnej, która nadaje roślinie wytrzymałość mechaniczną.
Skorupa z reguły jest bezbarwna i przezroczysta, łatwo przepuszcza światło słoneczne. Woda i rozpuszczone substancje o małej masie cząsteczkowej mogą się po niej poruszać. Każda komórka ma swoją własną powłokę; skorupy sąsiednich komórek są niejako cementowane substancjami międzykomórkowymi, które tworzą tak zwaną blaszkę środkową. W efekcie sąsiadujące ze sobą komórki są oddzielone od siebie ścianą utworzoną z dwóch muszli i płytki środkowej, co daje powód do nazywania otoczki również ścianą komórkową.
Powłoka jest zbudowana przez protoplast komórki i dlatego może rosnąć tylko poprzez kontakt z nią. Bardzo często otoczka utrzymuje się dłużej niż protoplast (kiedy komórka umiera wcześnie), ale zwykle nie prowadzi to do zaprzestania istnienia komórki jako jednostki strukturalnej, ponieważ kształt komórki nie zmienia się pod wpływem wytrzymałość skorupy. Dlatego nawet po śmierci komórki roślinne mogą pełnić ważne funkcje transportu roztworów lub wsparcia mechanicznego. Wiele rodzajów komórek roślinnych - włókna, tracheidy, segmenty naczyniowe, komórki korka - w stanie dorosłym to jedna błona komórkowa. W większości drewno składa się z muszli martwych komórek.
Błony komórkowe są tak różnorodne, jak same komórki. Skład i struktura błony często mogą być wykorzystane do oceny pochodzenia i funkcji komórek różnych typów. Tak więc struktura roślin kopalnych jest badana głównie poprzez badanie błon ich komórek.
Początkowo pierwotna ściana komórkowa wyrasta na zewnątrz z plazmalemmy. Składa się z polisacharydów - pektyny i celulozy. Pierwotne ściany komórkowe sąsiednich komórek są połączone blaszką środkową protopektyny. W ścianie komórkowej liniowe, bardzo długie cząsteczki celulozy, składające się z glukozy, układają się w wiązki - micele, które z kolei łączą się w fibryle - najcieńsze włókna o nieokreślonej długości. Celuloza tworzy wielowymiarowy szkielet, który zanurzony jest w amorficznej, silnie uwodnionej matrycy z węglowodanów niecelulozowych: pektyn, hemiceluloz itp. To właśnie celuloza decyduje o wytrzymałości ściany komórkowej. Mikrofibryle są elastyczne i mają podobną wytrzymałość na rozciąganie jak stal. Polisacharydy matrycowe decydują o takich właściwościach ściany jak wysoka przepuszczalność dla wody, rozpuszczonych małych cząsteczek i jonów oraz silne pęcznienie. Dzięki matrixowi woda i substancje mogą przemieszczać się z komórki do komórki wzdłuż sąsiadujących ze sobą ścian. Niektóre hemicelulozy mogą być odkładane w ścianach komórkowych nasion jako substancje rezerwowe.
Materiał skorupy, w tym celuloza, jest szeroko stosowany w przemyśle. Właściwości drewna, papieru, materiałów włókienniczych w dużej mierze zależą od budowy molekularnej i składu chemicznego skorupy, a znajomość tych właściwości pozwala na doskonalenie technologii produkcji i jakości wyrobów.
Skład chemiczny i organizacja molekularna otoczki. Błona komórkowa zbudowana jest głównie z polisacharydów, których monomery - cukry - połączone są ze sobą wiązaniem glikozydowym (-O-) w postaci łańcucha. Polisacharydy są nazywane zgodnie ze składem tworzących je monomerów, z dodatkiem końcówki „an”. Na przykład polisacharyd ksylan składa się z reszt cukru ksylozy, mannanu - mannozy, glukanu - glukozy itp.
Oprócz polisacharydów skład otoczki może obejmować białka, sole mineralne, ligninę, pigmenty, lipidy. Zwykle muszle są impregnowane wodą. Polisacharydy otoczkowe ze względu na pełnioną rolę można podzielić na substancje szkieletowe i substancje matrycowe. Szkieletowa substancja skorupy Wyższe rośliny to celuloza (włókno), chemicznie reprezentująca β-1,4-D-glukan. Liczba reszt glukozy w cząsteczce, a co za tym idzie długość samych cząsteczek, może się znacznie różnić w ścianach komórkowych różnych roślin, co wpływa na właściwości celulozy. Jego nitkowate cząsteczki w otoczce są ułożone równolegle do siebie i są pogrupowane po kilkadziesiąt w taki sposób, że powstaje charakterystyczna dla kryształów wydłużona trójwymiarowa siatka. Te grupy krystaliczne, w których tworzeniu biorą udział wiązania kowalencyjne i wodorowe, tworzą podstawę mikrofibryli - najcieńszych włókien, które tworzą ramę strukturalną skorupy, jej „wzmocnienie”.
Stan krystaliczny cząsteczek celulozy w mikrofibrylach determinuje dwójłomność ściany komórkowej, którą obserwuje się w mikroskopie polaryzacyjnym. W mikrofibrylach występują obszary parakrystaliczne, czyli obszary o luźniejszym równoległym, ale nieposiadającym trójwymiarowej orientacji ułożeniu cząsteczek celulozy. Stopień krystaliczności mikrowłókien, stosunek stref krystalicznych i parakrystalicznych różnią się dość silnie w zależności od rodzaju rośliny, stanu komórki i rodzaju otoczki, na co wpływają mechaniczne i fizyczne celulozy jako surowce. Średnica mikrofibryli również zmienia się w różnych komórkach (zwykle w granicach 10-30 nm), długość może dochodzić do kilku mikrometrów. Mikrofibryle można łączyć w osobne grupy lub warstwy - makrofibryle o grubości 0,4-0,5 mikrona, widoczne w mikroskopie świetlnym.
Rysunek 25
Podczas życia komórki, zwłaszcza w zależności od pełnienia jakiejkolwiek wyspecjalizowanej funkcji, zachodzą wtórne zmiany w ścianie komórkowej. Często są one związane z radykalnymi zmianami w jego składzie chemicznym, strukturze i właściwościach fizykochemicznych.
Niezdarny. Ściana komórkowa jest inkrustowana (impregnowana) specjalną substancją - ligniną, która zwiększa twardość, kaloryczność, gęstość ściany komórkowej oraz zmniejsza jej plastyczność i zdolność do wzrostu. Zdrewniałe ściany komórkowe nie tracą zdolności przepuszczania wody i powietrza. Ich protoplast może pozostać przy życiu, chociaż zwykle umiera. Tarcica jest bardzo rozpowszechniona w przyrodzie. Daje siłę pniom i gałęziom drzew. Drewno iglaste i liściaste zawiera do 50% celulozy i 20...30% ligniny. Zdrewniałe ściany komórkowe i wiele ziół, zwłaszcza pod koniec sezonu wegetacyjnego.
Sondowanie lub suberynizacja. W wyniku obfitego nawarstwiania się w ścianie komórkowej substancji chemoodpornej - suberyny, powstaje jej suberyna. Ze względu na swój charakter chemiczny suberyna jest zbliżona do tłuszczów. Jest to amorficzny związek hydrofobowy, który składa się z wysokopolimerowych nasyconych kwasów tłuszczowych i złożonych hydroksykwasów. Suberyna odkłada się głównie w ścianach komórkowych wtórnej tkanki powłokowej - korku, który jest doskonałym izolatorem wody i ciepła. W niewielkich ilościach gromadzi się w ścianach komórkowych różnych tkanek. Przy całkowitym zakorkowaniu protoplast komórki umiera, ponieważ blaszki suberyny zapobiegają przenikaniu wody i powietrza, przy częściowym - protoplast zachowuje się przez długi czas.
Mineralizacja. W procesie życia ściany powierzchniowych komórek pędów mogą gromadzić substancje mineralne, zwłaszcza krzemionkę i węglan wapnia.Niektóre grupy roślin, np. wiele rodzajów turzyc, traw, skrzypów, zawsze mają komórki tkanki powłokowej , naskórek, mocno inkrustowany solami. Co więcej, nie tylko ściana komórkowa może być inkrustowana, ale także różne wyrostki naskórka - trichomy. Ponadto substancje mineralne osadzają się na powierzchni komórek tkanki powłokowej - naskórka. W wyniku mineralizacji narządy osiowe uzyskują większą wytrzymałość mechaniczną.
Odchudzanie. Przekształcenie celulozy i pektyny w śluz i blisko nich dziąsła, które są polimerycznymi węglowodanami, które wyróżniają się zdolnością do silnego pęcznienia w kontakcie z wodą. Śluzy obserwuje się w komórkach komórkowych okrywy nasiennej, na przykład w lnie. Tworzenie się śluzu ma ogromne znaczenie adaptacyjne. Kiedy nasiona kiełkują, śluz utrwala je w określonym miejscu, łatwo wchłania i zatrzymuje wilgoć, chroni nasiona przed wysychaniem i poprawia reżim wodny sadzonek. Śluz ścian komórkowych korzeni vlosk zapewnia ich silne wiązanie z cząstkami gleby.
Maceracja to rozpuszczanie substancji międzykomórkowej, prowadzące do rozdzielenia komórek. W dojrzałych owocach zachodzi naturalna maceracja. Przeprowadza się to sztucznie, na przykład, gdy len jest płatkowany w celu uwolnienia przędzalniczych surowców - grup komórek włókien łykowych.
Opis pracy
Cechą charakterystyczną jest obecność mocnej skorupy komórka roślinna odróżnia ją od komórki zwierzęcej. Otoczka nadaje komórce określony kształt i wytrzymałość oraz chroni żywą zawartość - protoplast, a przede wszystkim plazmalemę, mocno dociśniętą do skorupy od wewnątrz. Uprawiane na specjalnych pożywkach komórki roślin wyższych, w których błona jest usuwana metodą enzymatyczną, przybierają zawsze kulisty kształt.
